下列有关离子的检验方法和判断正确的是
| A.向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ |
| B.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ |
| C.向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- |
| D.用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+)>c(H+)>c(OH﹣)>c(A﹣)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na2CO3)<c(CH3COONa)<c(NaOH)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO﹣)+2c(OH﹣)=2c(H+)+c(CH3COOH)
D.0.1mol•L﹣1的NaHA溶液,其pH=4:c(HA﹣)>c(H+)>c(H2A)>c(A2﹣)
如图表示水中c(H+)和c(OH﹣)的关系,下列判断错误的是
| A.两条曲线间任意点均有c(H+)×c(OH﹣)=KW |
| B.XZ线上任意点均有pH=7 |
| C.图中T1<T2 |
| D.M区域内任意点均有c(H+)<c(OH﹣) |
在密闭容器中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变小 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a > c+d |
将固体A置于密闭容器中,在一定温度下发生下列反应:
①A(s) B(g)+C(g);②2C(g)
B(g)+C(g);②2C(g) D(g)+E(g)。
D(g)+E(g)。
达到平衡时,c(D)=0.5mol·L-1,c(C)=4mol·L-1,则此温度下反应①的平衡常数为
A.25 B.20 C.16 D.9
对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )
A. |
B.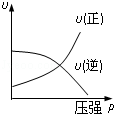 |
C.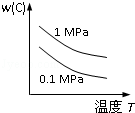 |
D. |