室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示。下列叙述正确的是( )
的变化如图所示。下列叙述正确的是( )

| A.稀释前两溶液的Ka:MOH溶液>ROH溶液 |
| B.ROH的电离程度:b点小于a点 |
| C.两溶液在稀释过程中,c(H+)均逐渐减少 |
D.当 时,若两溶液同时升高温度,则 时,若两溶液同时升高温度,则 增大 增大 |
下列化学反应的离子方程式正确的是
| A.次氯酸钠漂液中加浓盐酸产生氯气:ClO- + Cl-+2H+=Cl2↑+H2O |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3 +2HClO +2HClO |
C.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S |
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO =CaSO4 =CaSO4 +H2O +H2O |
把0.6 mol X气体和0.4 mol Y气体混合于容积为2 L的容器中,使其 发生反应
发生反应
3X(g)+Y(g)===nZ(g)+2W(g).5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol/(L·min),则n的值为
| A.1 | B.2 | C.3 | D.4 |
下列变化规律错误的是
| A.微粒半径:F – < Cl – < Br – < I – | B.稳定性:HI< HBr <HCl< HF |
| C.沸点:HF< HCl < HBr< HI | D.阴离子还原性:F – < Cl – < Br – < I – |
下列叙述中正确的是(NA为阿伏加德罗常数)
| A.通常状况下将0.5mol HI气体和0.5 mol Cl2混合后,气体的分子数小于NA |
| B.同温同压下,相同体积的物质,其物质的量必相等 |
| C.5.3g Na2CO3固体含有的离子数为1.5NA |
| D.标准状况下,0.5 NA个Br2所占的体积约为11.2L |
如图所示是短周期的一部分,已知B原子与C 原子核外电子总数 之和为A的4倍,则下列推断正确的是
之和为A的4倍,则下列推断正确的是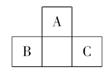
A.A、B、C三者中,A为金属性元素,B、C为非金属性元素
B.A、B、C三者核电荷数之和为40
C.A与B、A与C均可形成离子化合物 D.B与C只能形成一种共价化合物