室温下,将0.4mol/L一元酸HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化),测得混合液的pH=5,则下列说法或粒子浓度关系式正确的是( )
A.混合液中由水电离出的c(H+)=1×10-8mol/L
B.c(A-)+c(HA)=2c(Na+)=0.4mol/L
C.HA溶液中 与混合液中
与混合液中 相等
相等
D.c(A-)-c(HA)=2c(OH-)-2c(H+)
将m g的铜放入足量的稀硝酸中充分反应后(铜反应完全),生成n L(标准状况)NO,则被还原的硝酸为
①63n/22.4 g ②n/22.4 g ③m/96 mol④42m mol
| A.①④ | B.①③ | C.②④ | D.②③ |
X、Y为同主族元素,如果X的原子半径大于Y,则下列判断不正确的是
| A.若X、Y均为金属元素,则X的金属性强于Y |
| B.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子氧化性强 |
| C.若X、Y均为非金属元素,则Y的气态氢化物比X的稳定 |
| D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X |
下图是氯气的制备以及氯、溴、碘的非金属性比较实验,充分反应一段时间后,打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察实验现象,下列说法正确的是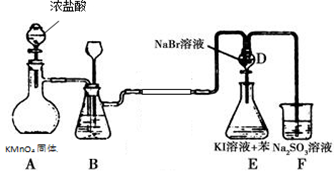
| A.F2不能与NaCl溶液反应置换出氯气 |
| B.装置B中可盛放水吸收氯气中的HCl气体 |
| C.装置E下层呈现紫红色 |
| D.装置E中有机试剂层呈现紫红色,能说明非金属性Br>I |
在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A.H2S+2HNO3 S↓+2NO2↑十2H2O S↓+2NO2↑十2H2O |
B.4HNO3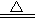 4NO2↑十O2↑十2H2O 4NO2↑十O2↑十2H2O |
C.3FeO+10HNO3  3Fe(NO3)3十5H2O + NO↑ 3Fe(NO3)3十5H2O + NO↑ |
D.CuO+2HNO3 3Cu(NO3)2+H2O 3Cu(NO3)2+H2O |
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
| A.检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液 |
| B.为增强高锰酸钾的氧化能力,向高锰酸钾溶液中加入稀硝酸酸化 |
| C.检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液 |
| D.检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液 |