盖斯定律和中和反应原理在生产和科学研究中有很重要的意义。
(1)已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l) △H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=__________。
(2)用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现

其中,反应①的热化学反应方程式为:2HCl(g)+ CuO(s) H2O(g)+CuCl2(s) △H1
H2O(g)+CuCl2(s) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为_________________(反应热用△H1和△H2表示)。
(3)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,则两溶液的pH的关系式为x+y=________(填表达式)。
纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___________________________。
(2)写出“联合制碱法”有关反应的化学方程式:_______________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________。
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应列出计算原子利用率的表达式:原子利用率(%)=_________________。
苏打和小苏打有着广泛的应用。试从反应物用量角度说明在下列用途中选A(苏打)还是B(小苏打),并说明原因。
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的面碱,选用______,因为______________________________
(2)作为泡沫灭火器的药品,选用________,因为________________________
(3)用于洗涤餐具及实验室的玻璃仪器等,选用________,因为_____________
(4)治疗胃酸过多时,选用________,因为_______________________________
(提示:二者水溶液均显碱性,且苏打的碱性强)
四川有丰富的天然气资源,以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):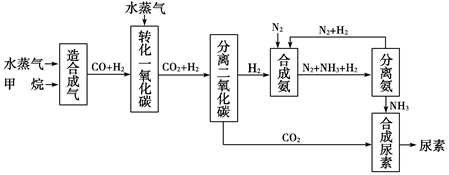
请填写下列空白:
(1)已知0.5 mol甲烷与0.5 mol水蒸气在t ℃、p kPa时,完全反应生成一氧
化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是:______________________。
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请运用化学反应速率和化学平衡的观点说明采取该措施的理由:
________________________________________________________________。
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成________L氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为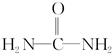 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
①__________________;②_________________。
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
| A.采用较高压强 |
| B.采用500 ℃的高温 |
| C.用铁触媒作催化剂 |
| D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔 |
中,并补充N2和H2
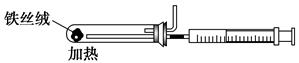
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924kJ,原因是______________________________
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。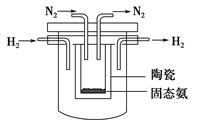
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
| 项目 |
H2 |
N2 |
NH3 |
| 起始时 |
5 mol·L-1 |
3 mol·L-1 |
0 |
| 2 s末 |
2 mol·L-1 |
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=__________。若此时已达平衡,则可求得平衡常数为__________。
(2)下图表示合成NH3反应在时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是__________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6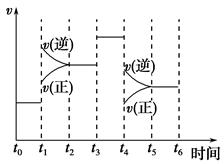
若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH________0(填“大于”或“小于”)。