下列事实不能证明CH3COOH是弱电解质的是( )
①0.1mol/L的CH3COOH溶液的pH=2.1;②CH3COONa和盐酸反应,生成CH3COOH; ③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多;④常温下某CH3COONa溶液的pH=8;⑤用CH3COOH溶液做导电实验,灯泡很暗;⑥0.1mol/L的CH3COOH溶液稀释100倍,pH<3
| A.②⑤ | B.①②③ | C.⑤ | D.③④⑤⑥ |
温度一定时,在密闭容器中发生可逆反应:mA(S)+nB(g) pC(g),达到平衡后,若将混合气体的体积压缩到原来的
pC(g),达到平衡后,若将混合气体的体积压缩到原来的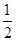 ,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中,正确的是
,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中,正确的是
| A.平衡向逆反应方向移动 |
| B.C气体的体积分数增大 |
| C.气体A的转化率升高 |
| D.m+n<p |
对于可逆反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列叙述正确的是
2SO3(g) ΔH<0,下列叙述正确的是
| A.单位时间内生成2molSO3的同时消耗了1molO2,则反应到达平衡状态 |
| B.升高温度反应速率增大,由于该反应是放热反应,V(逆)小于V(正),所以反应达到平衡的时间将延长 |
| C.保持温度和密闭体系体积不变,起始加入2molSO2和1molO2,平衡后加入2molSO2和1molO2,重到达平衡时SO2的体积分数减小 |
D.该反应的化学平衡常数表达式为 |
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成nmolCO的同时生成nmolH2 |
| D.1molH—H键断裂的同时断裂2molH—O键 |
下列有关热化学方程式的叙述正确的是
| A.2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
| B.已知C(石墨,s) = C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2(g);△H1;2C(s)+O2(g)="2CO(g)" △H2。则△H1>△H2 |
.已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.v(CO)=1.5mol·L-1·min-1 |
| B.v(NO2)=0.7mol·L-1·min-1 |
| C.v(N2)=0.4mol·L-1·min-1 |
| D.v(CO2)=1.1mol·L-1·min-1 |