以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
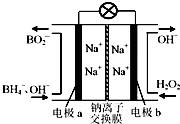
| A.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| B.电池放电时Na+从b极区移向a极区 |
| C.每消耗3mol H2O2,转移的电子为3mol |
| D.该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
高温下,超氧化钾晶体(KO2)呈立方体结构(与NaCl晶体结构相似)。如图为超氧化钾晶体的一个晶胞。则有关下列说法不正确的是
| A.KO2中既存在离子键也存在共价键 |
| B.一个KO2晶胞中摊得的K+和O2-粒子数均为4个 |
| C.晶体中与每个K+距离最近的O2-有8个 |
| D.与K+距离相等且最近的K+有12个 |
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是
| A.该晶体属于原子晶体,其化学键比金刚石中的碳碳键更牢固 |
| B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 |
| C.该晶体中碳原子和氮原子的最外层都满足8电子结构 |
| D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构 |
下列说法错误的是
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.晶格能是气态离子形成1摩离子晶体释放的能量,晶格能越大,形成的离子晶体越稳定 |
D.由于N2和O22+互为等电子体,所以可以推断O22+的电子式为 |
图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2)。分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是
| A.CF4 | B.CH4 | C.NH | D.H2O |
某物质结构如图。下列有关该物质的说法正确的是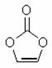
| A.分子式为C3H4O3 | B.分子中含8个σ键 |
| C.分子中只有极性键 | D.8.6g该物质完全燃烧得到6.72LCO2 |