已知碳酸氢钾溶液显碱性,25℃时向10mL0.01mol/LKHCO3溶液中滴加0.01mol/LKOH溶液,随着KOH溶液体积的增加,溶液中微粒浓度关系正确的是( )
| A.V(KOH)=0时,溶液中c(K+)=c(HCO3-)+c(H2CO3) |
| B.V(KOH)=10mL时,溶液中c(HCO3-)>c(H2CO3) |
| C.V(KOH)=20mL时,溶液中c(K+)>c(CO32-)>c(OH-)>c(H+) |
| D.对V(KOH)=10mL时的溶液升温,溶液中:c(K+)>c(OH-)>c(CO32-)>c(H+) |
下列反应的产物中,有的有同分异构体,有的没有同分异构体。其中一定不存在同分异构体的反应是( )
A.异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 |
B.2-氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 |
| C.甲苯在一定条件下发生硝化生成一硝基甲苯 |
| D.溴苯在NaOH水溶液中发生水解反应 |
为了使氯乙烷的水解反应进行得比较完全,水解时需加入( )
| A.NaCl | B.NaHSO4 | C.HCl | D.NaOH |
以溴乙烷为原料制备1,2-二溴乙烷,下列方案中最合理的是( )
A.CH3CH2Br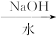 CH3CH2OH CH3CH2OH CH2==CH2 CH2==CH2 CH2BrCH2Br CH2BrCH2Br |
B.CH3CH2Br CH2BrCH2Br CH2BrCH2Br |
C.CH3CH2Br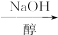 CH2==CH2 CH2==CH2 CH2BrCH3 CH2BrCH3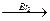 CH2BrCH2Br CH2BrCH2Br |
D.CH3CH2Br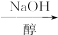 CH2==CH2 CH2==CH2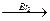 CH2BrCH2Br CH2BrCH2Br |
能与KOH的醇溶液共热发生消去反应的是( )
A. B. CH3—Cl
B. CH3—Cl
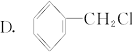
下列物质中,不属于卤代烃的是( )
| A.氯乙烯 | B.溴苯 |
| C.四氯化碳 | D.硝基苯 |