用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。下列说法中正确的是
| A.燃料电池工作时,负极反应为:H2-2e- = 2H+ |
| B.若要实现铁上镀铜,则a极是铁,b极是铜 |
| C.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,a极析出铜64g |
下列物质中可使酸性高锰酸钾溶液褪色,不能使溴水褪色的是( )。
| A.甲烷 | B.乙烯 | C.乙醇 | D.苯 |
已知:CH4+Br2 CH3Br+HBr;
CH3Br+HBr;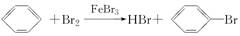
将甲苯与液溴混合,加入铁粉,其反应产物可能有( )。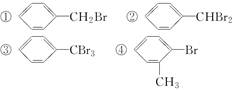

| A.只有①②③ | B.只有④⑤⑥⑦ | C.只有①⑤ | D.①②③④⑤⑥⑦ |
在一定条件下,等物质的量的乙烯和苯分别和足量氢气发生加成反应,消耗氢气的物质的量之比为( )。
| A.1∶1 | B.1∶2 | C.1∶3 | D.1∶4 |
下列反应中前者属于取代反应,后者属于加成反应的是( )。
| A.光照甲烷与氯气的混合物;乙烯使酸性KMnO4溶液褪色 |
| B.乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 |
| C.苯滴入浓硝酸和浓硫酸的混合液中并水浴加热;乙烯与水蒸气在一定条件下反应生成乙醇 |
| D.在苯中滴入溴水,溴水褪色;乙烯使溴水褪色 |
对于苯乙烯(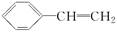 )有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面。其中正确的是( )。
)有下列叙述:①能使酸性KMnO4溶液褪色;②能使溴的四氯化碳溶液褪色;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面。其中正确的是( )。
| A.①②③④⑤ | B.①②⑤⑥ | C.①②④⑤⑥ | D.全部正确 |