CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过如图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是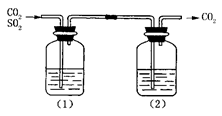
| A.(1)NaOH(2)浓H2SO4 | B.(1)浓H2SO4(2)NaOH |
| C.(1)浓H2SO4(2)Na2CO3 | D.(1)饱和NaHCO3(2)浓H2SO4 |
哈伯因发明氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,正反应和逆反应的速率都为零 |
| D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
对于可逆反应2SO2+O2 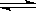 2SO3 ,在反应体系中充入一定量的18O2 ,足够长的时间后,18O原子
2SO3 ,在反应体系中充入一定量的18O2 ,足够长的时间后,18O原子
| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
质量相同的氢气分别在足量氧气中燃烧,充分反应,(1)生成液态水,(2)生成水蒸气
| A.反应(1)放出的热量多 | B.反应(2)放出的热量多 |
| C.(1)、(2)放出的热量一样多 | D.无法比较两个反应放出的热量 |
下列叙述中,错误的是
| A.原子半径 Cl>S>O | B.还原性 Na>Mg>Al |
| C.稳定性 HF>HCl>HBr | D.酸性 HClO4>H2SO4>H3PO4 |
X元素的阳离子和Y元素阴离子具有与氩原子相同的电子层结构,下列叙述正确的是
| A.X的原子序数比Y的小 | B.X原子的最外层电子数比Y的多 |
| C.X的离子半径比Y的大 | D.X的原子半径比Y的大 |