下列有关实验现象或结论的描述不正确的
| A.铅蓄电池充电时,阳极的反应为:PbSO4+2H2O+2e-=PbO2+SO42-+4H+ |
| B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ |
| C.常温下将5mL0.1mol/LNa2S2O3溶液、5mL0.01mol/LNa2S2O3溶液分别与5mL0.1mol/LH2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响 |
| D.处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
将相同质量的铜片分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
| A.反应速率,两者相同 |
| B.消耗硝酸的物质的量:前者多,后者少 |
| C.反应生成气体的颜色:前者浅,后者深 |
| D.反应中转移的电子总数:前者多,后者少 |
在一定温度和压强下,将装有N2和NO2混合气体的试管倒立于水槽中,最后试管内气体的体积缩小为原体积的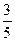 ,则混合气体中N2与NO2的体积比是
,则混合气体中N2与NO2的体积比是
| A.2:3 | B.3:2 | C.3:5 | D.5:3 |
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y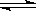 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于
| A.33% | B.40% | C.50% | D.67% |
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+7/2O2+14e-=14OH-。有关此电池的推断正确的是
| A.通氧气的电极为负极 |
| B.参加反应的O2与C2H6的物质的量之比为7∶2 |
| C.电池工作一段时间后,KOH的物质的量浓度不变 |
| D.电池工作时,溶液中OH-离子向正极移动 |
下列说法不正确的是
| A.在原电池的负极和电解池的阳极上都是发生失电子的氧化反应 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |