下列各组微粒中,互为同素异形体的是
| A.H和D | B.O2和O3 |
| C.CH3CH2CH2CH3和(CH3)3CH | D.H2O和D2O |
某学生设计了如下方法对X盐进行鉴定:
由此分析,下列结论中正确的是
| A.X中一定有Fe3+ | B.X一定为FeBr2溶液 |
| C.Y为AgI沉淀 | D.Z中一定有Fe3+ |
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2,NO和H2O。当产物n(NO2):n(NO)=1:1时,下列说法错误的是
| A.1 mol Cu2S参加反应时有10 mol电子转移 |
| B.参加反应的n(Cu2S):n(HNO3)=1:5 |
| C.反应中Cu2S作还原剂 |
| D.产物n[Cu(NO3)2] : n[CuSO4 ]=l:1 |
W、X、Y、Z是短周期元素,其部分性质如下表:
| W |
单质是淡黄色固体 |
| X |
在地壳中的含量居第二位 |
| Y |
原子最外层电子数是电子总数的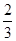 |
| Z |
第3周期原子半径最小的金属 |
下列说法正确的是
A.气态氢化物的热稳定性:X>W
B.非金属性:Y < W;离子半径:Z > W
C.W在空气中燃烧所得产物,可用于杀菌消毒
D.金属Z与少量NaOH溶液反应,生成两性氢氧化物
下列离子方程式与所述事实相符且正确的是
| A.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=== 4Fe3++6Cl-+Br2 |
| B.磁性氧化铁溶于氢碘酸:Fe3O4+8H+=== 2Fe3++Fe2++4H2O |
| C.放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2===2I2+2H2O[来 |
| D.向硝酸铵溶液中滴加NaOH溶液:NH4++OH-=== NH3↑+ H2O |
下列现象及结论均正确的是
| 现象 |
结论 |
|
| A |
向Na2O2与水反应完的溶液中,滴加石蕊试液,溶液先变蓝后褪色 |
Na2O2与水反应后的溶液呈碱性,且有少量的Na2O2剩余,而氧化石蕊使其褪色 |
| B |
将盐酸与NaHCO3反应生成的CO2气体,直接通入Na2SiO3溶液中出现浑浊 |
说明碳的非金属性强于硅 |
| C |
Na2S溶液与Na2SO3溶液混合后出现浑浊 |
发生反应的离子方程式为: 2S2-+SO32-+3H2O === 3S↓+6OH- |
| D |
用饱和食盐水吸收氯气中混有的HCl气体,出现白色浑浊 |
白色浑浊为析出的氯化钠晶体 |