设阿伏加德罗常数为NA,则下列说法正确的是
| A.11.2L NH3中含有的氢原子数为1.5NA |
| B.0.2mol/L AlCl3溶液含有0.2NA个Al3+ |
| C.常温常压下,18g水的原子数为3NA |
| D.O2与O3的混合物32g,含有分子数为NA |
卤素单质与氢气都能反应,反应产物是卤化氢(X2+H2===2HX),这是卤素性质的相似性;但其反应条件不同,从“黑暗中即可剧烈爆炸”→“不断加热才能缓慢反应”,这是其性质的递变性。其性质递变性的原因是( )
| A.最外层电子数相同 | B.都是双原子分子 |
| C.电子层数递增 | D.卤化氢中卤素都是-1价 |
某阳离子Mn+的核外共有x个电子,核内有a个中子,则M的质量数为
| A.a+x-n | B.a+x+n | C.a-x-n | D.a-x+n |
下列有关SO2的性质的探究实验报告记录的实验现象正确的是()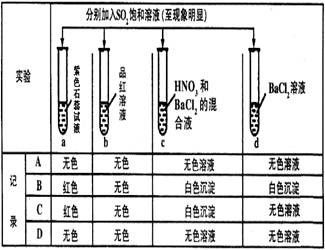
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
| A.肯定只有SO2和NO | B.肯定没有Cl2、O2和NO |
| C.可能有Cl2和O2 | D.肯定只有NO |
香烟烟雾中含有CO、CO2、SO2、H2O等气体,用① 无水CuSO4② 澄清石灰水 ③红热CuO ④ 生石灰⑤ 品红溶液⑥ 酸性高锰酸钾溶液等药品可将逐一检出,检测时香烟烟雾通入药品的正确顺序是()
| A.①——⑤——②——⑥——④——③ |
| B.①——⑤——⑥——②——④——③ |
| C.③——④——②——⑥——⑤——① |
| D.②——⑤——①——④——③——⑥ |