下列各反应的化学方程式中,属于水解反应的是
A.HCO3— + H2O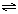 CO32—+ H3O+ CO32—+ H3O+ |
B.H2O + H2O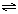 OH— + H3O+ OH— + H3O+ |
C.CO2 + H2O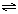 H2CO3 H2CO3 |
D.CO32— +H2O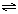 HCO3— + OH— HCO3— + OH— |
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH—)>c(HA)>c(HB)>c(H+)
B.c(OH—)>c(A—)>c(B—)>c(H+)
C.c(OH—)>c(B—)>c(A—)>c(H+)
D.c(OH—)>c(HB)>c(HA)>c(H+)
下列各组溶液中,微粒的物质的量浓度关系正确的是
| A.0.1mol/L Na2CO3溶液:c(OH—) = c(HCO3—) + c(H+)+ c(H2CO3) |
| B.0.1mol/L NH4Cl溶液:c(NH4+)= c(Cl—) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO—)>c(H+)>c(OH—) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)= c(NO3—) |
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化
| A.V1>V2 | B.V1<V2 | C.V1=V2 | D.V1≤V2 |
下列四种溶液中①pH=0的盐酸 ②0.1mol/L的盐酸 ③0.01mol/L的NaOH溶液 ④pH=14的NaOH溶液,由水电离生成的H+浓度之比①:②:③:④是
| A.1:10:100:1 | B.1:10—1:10—12:10—14 |
| C.14:13:12:14 | D.14:13:2:1 |