汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:

①该反应的ΔH________0(填“>”“<”)。
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是___________(填代号)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)=N2O4(g)ΔH=-56.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式_____________。
(3)已知反应:CO2(g)+H2(g) CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡 所需时间/min |
||
| CO2(g) |
H2(g) |
H2O(g) |
CO2(g) |
|||
| 1 |
650 |
2 |
1 |
0.4 |
1.6 |
6 |
| 2 |
900 |
4 |
2 |
1.6 |
2.4 |
2 |
①实验1条件下平衡常数K=____________(保留小数点后二位)。
②该反应的ΔH____________0(填“<”或“>”)。
Na2O2可用在潜水艇里作为氧气的一种来源,供人们呼吸所需。Na2O2所发生反应的化学方程为 。在这个反应中,电子转移的总数为 被氧化的是 价态 元素,氧化剂是 。
如下图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
(1)B中X 的转化率α(X)B为。
(2)A中W和B中Z的物质的量的比较:n(W)An(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为升(用a表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是。
(10 分)(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的P亚层上有3个电子。
①写出甲元素的电子排布式________________________;
②甲、乙元素的第一电离能关系为甲乙(填>、<、=);两元素可形成硬度大于金刚石的一种化合物,该化合物属于______晶体,其化学式为_____________,若使其熔化,需破坏的作用关系为___________________.
(2)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物,其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示:图中左右两边对称,各含一个近似为立方体的结构,每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一个化学键。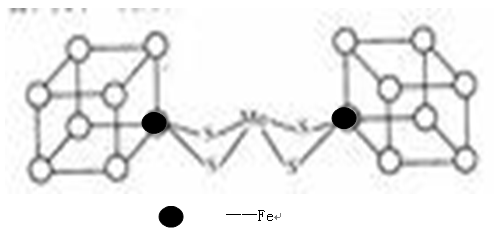
①请在图中左边立方体的○中填写出(在○涂黑)其余3个Fe原子
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4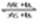 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是;电解液中H2SO4的浓度将________(填变大、变小、不变);当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成_____、B电极上生成_____________,此时铅蓄电池的正负极的极性将________________。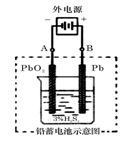
.下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4500ml的操作,请按要求填空:
(1)所需浓H2SO4的体积为mL
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的小烧杯里,并不断搅拌,目的是。