甲、乙、丙、丁分别是氢氧化钡溶液、氯化钾溶液、碳酸钠溶液、硝酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是( )
| A.乙一定是氯化钾溶液 | B.甲一定是氢氧化钡溶液 |
| C.丙不可能是碳酸钠溶液 | D.丁只能是硝酸 |
绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。以下几种生产乙苯(反应均在一定条件下进行)的方法中符合绿色化学原理的是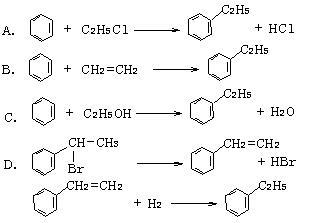
化学与生活、社会密切相关。下列说法不正确的是
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.提倡人们购物时不用塑料袋,是为了防止白色污染 |
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是
A.淀粉 葡萄糖 葡萄糖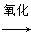 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
B.纤维素 葡萄糖 葡萄糖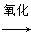 CO2和H2O(释放能量维持生命活动)[ CO2和H2O(释放能量维持生命活动)[ |
C.油脂 甘油和高级脂肪酸 甘油和高级脂肪酸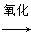 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
D.蛋白质 氨基酸 氨基酸 人体所需的蛋白质(人体生长发育) 人体所需的蛋白质(人体生长发育) |
某有机物的结构如右图所示,这种有机物不可能具有的性质是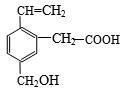
①可以与氢气发生加成反应;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;⑤能发生加聚反应;⑥能发生水解反应
| A.①④ | B.只有⑥ | C.只有⑤ | D.④⑥ |
下列说法中不正确的是
①水分子的电子式为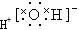 ②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
③氮分子的电子式为 ④只含有离子键的化合物才是离子化合物
④只含有离子键的化合物才是离子化合物
| A.①② | B.③④ | C.①④ | D.②③ |