已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是( )
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4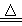 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
| A.KClO3在反应中得到电子 |
| B.ClO2是氧化产物 |
| C.H2C2O4中的碳是+6价,在反应被还原 |
| D.1 mol KClO3参加反应有2mol电子转移 |
根据下列反应判断有关物质还原性由强到弱的顺序正确的是
(1)H2SO3 + I2 + H2O =" 2HI" + H2SO4
(2)2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
(3)3FeCl2 + 4HNO3 = 2FeCl3 + NO↑+ 2H2O + Fe(NO3)3
| A.H2SO3>I->Fe2+>NO |
| B.I->H2SO3>Fe2+>NO |
| C.Fe2+>I->H2SO3>NO |
| D.NO>Fe2+>H2SO3>I- |
在强碱性溶液中能大量共存,并且溶液为无色透明的离子组是
| A.Na+、Mg2+、NO3-、Cl- | B.K+、Na+、CO32-、NO3- |
| C.K+、Ba2+、HCO3-、Cl- | D.Na+、K+、MnO4-、SO42- |
下列氧化还原反应的表示方法,正确的是: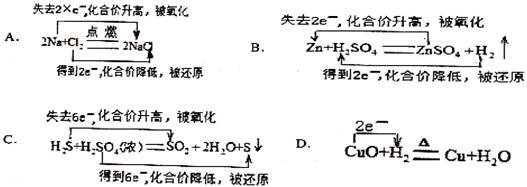
下列实验操作或记录正确的是
| A.常温常压下测得1 mol N2的质量为28 g |
| B.用量筒测得排水法收集制得的氢气的体积为50.28 mL |
| C.用两只250 mL的容量瓶配制0.1 mol·L-1 500 mL的NaOH溶液 |
| D.用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |