(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=____________.(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH________7(>、≥ 、=、<)。
②若溶液pH>7,则c(Na+)________c(A-),理由是________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是______(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
今有分子量为58的几种有机物,试推断符合条件的有机物的分子式或结构简式
(1)若该有机物为烃,则分子式为,其中带有支链的同分异构体在核磁共振氢谱图中有个吸收峰
(2)若该有机物是一种饱和一元脂肪醛,则其与新制氢氧化铜悬浊液在加热条件下反应的化学方程式为。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则其结构简式为。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则其结构简式为,(注羟基连在双键上的有机物极不稳定)该物质生成高分子化合物的化学方程式为。
选用适当的试剂和方法除去下列物质中的杂质(括号内)填下表:
除杂质的试剂:①氢氧化钠溶液②溴水③生石灰④饱和碳酸钠溶液
除杂质的方法:A分液 B萃取 C蒸馏 D过滤
| 混合物 |
除杂质的试剂 |
除杂质的方法 |
| 苯(苯酚) |
(1) |
(4) |
| 酒精(水) |
(2) |
(5) |
| 乙酸乙酯(乙酸) |
(3) |
(6) |
(1)按系统命名法,有机物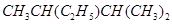 的名称是 。若该有机物是由烯烃加成氢气得来的,那么烯烃的结构有种,若该有机物是由炔烃加成氢气得来的,那么炔烃的结构简式该炔烃与含等物质的量的溴的四氯化碳反应的方程式为
的名称是 。若该有机物是由烯烃加成氢气得来的,那么烯烃的结构有种,若该有机物是由炔烃加成氢气得来的,那么炔烃的结构简式该炔烃与含等物质的量的溴的四氯化碳反应的方程式为
(2)支链只有一个乙基且式量最小的烷烃 的结构简式
氯化钠样品含有少量的Na2SO4和 Na2CO3,按下列流程进行净化,请在流程中的()中写上合适的试剂,在[ ]中写上实验操作名称
写出有关反应的化学方程式:
第步②
第步③
第步⑤
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
| 序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
| ① |
溶解 |
将混合物放入烧杯中,加入98% H2SO4,充分搅拌直到固体不再溶解。 |
| ② |
||
| ③ |
||
| ④ |
||
| ⑤ |
洗涤沉淀 |
|
| ⑥ |
检验沉淀 是否洗净 |