下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| B.向盐酸中滴加氨水:H++OH﹣═H2O |
| C.金属钠与水反应:2Na + 2H2O=2Na+ +2OH- +H2↑ |
| D.用FeCl3溶液腐蚀印刷电路铜板:Fe3++ Cu= Fe2++ Cu2+ |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
| A.明矾与水反应成的Al(OH)3胶体能吸附水中悬浮物,可用于净水 |
| B.江河入海口三角洲的形成通常与胶体的性质有关系 |
| C.水泥厂、冶金厂用高压电作用于气溶胶以除去烟尘,是利用了电泳原理 |
| D.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 |
向含1mol Na2CO3的饱和溶液中缓缓通入CO2气体使之充分反应,下列图像表示正确的是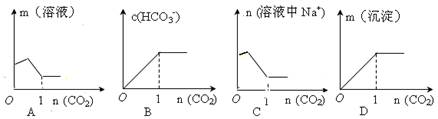
只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO)3、CuSO4五种溶液,这种试剂是
| A.盐酸 | B.硫酸 | C.NaOH溶液 | D.NaNO3溶液 |
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
| A.焰火中呈现的绚丽色彩,是各种金属元素焰色反应形成的 |
| B.小苏打既是制作糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰 |
| D.装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是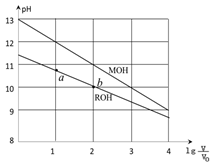
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
C.当 =2时,若两溶液同时升高温度,则c(M+)/c(R+)增大 =2时,若两溶液同时升高温度,则c(M+)/c(R+)增大 |
| D.若两溶液无限稀释,则它们的c(OH-)相等 |