下列反应中,属于氧化还原反应的是
| A.CaO+H2O═Ca(OH)2 |
B.CH4+2O2 2H2O+CO2 2H2O+CO2 |
C.CaCO3 CaO+CO2↑ CaO+CO2↑ |
| D.Ca(ClO)2+2HCl═CaCl2+2HClO |
下列各化学式中,只表示一种纯净物的是
| A.C2H6O | B.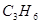 |
C.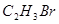 |
D.C2H4O2 |
下列变化过程中,不涉及化学变化的是
| A.用油脂制备肥皂 |
| B.甘油加水作护肤剂 |
| C.烹鱼时,加入少量的料酒和食醋可减少腥味,增加香味 |
| D.交警用酸性重铬酸钾试纸检验酒驾的原理 |
检验酒精中是否含有水,可选用的试剂是
| A.金属钠 | B.浓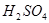 |
C.无水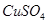 |
D.胆矾 |
下列说法错误的是
| A.蔗糖和淀粉都是非还原性糖 |
| B.纤维素由葡萄糖分子缩合而成,能表现出多元醇的性质 |
| C.蛋白质的水溶液加入铜盐,可以发生盐析 |
| D.天然蛋白质水解产物都是α-氨基酸 |
常温常压下为无色液体,而且密度小于水的是
① 苯② 硝基苯③ 溴苯 ④ 四氯化碳⑤ 溴乙烷⑥ 乙酸乙酯
| A.①⑥ | B.②③④⑥ | C.②③④⑤ | D.③④⑤⑥ |