在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
A.CH3OH(l)+ O2(g)═CO2(g)+2H2O(l);△H="+725.8" kJ/mol O2(g)═CO2(g)+2H2O(l);△H="+725.8" kJ/mol |
| B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=﹣1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=﹣725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H="+1452" kJ/mol |
反应A+B→C(∆H<0)分两步进行:①A+B→X(∆H>0),②X→C(∆H<0)。下列示意图中,能正确表示总反应过程中能量变化的是
常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是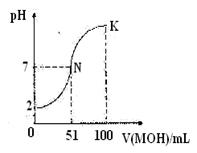
| A.HA为弱酸 |
| B.在N到K间任意一点对应的溶液中: c(M+)+c(H+) = c(OHˉ)+c(Aˉ) |
| C.K点对应的溶液中:c(M+)+c(MOH)=c(Aˉ) |
| D.常温下,MA溶液的pH>7 |
可逆反应COCl2(g) 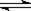 CO(g)+Cl2(g) ΔH > 0达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH > 0达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
将1 mol CO和2 mol H2充入一容积为1 L的密闭容器中,分别在250℃、T℃下发生反应:CO(g)+2H2(g)  CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是
CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是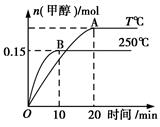
| A.250℃时,0~10 min H2反应速率为0.015 mol/(L·min) |
| B.平衡时CO的转化率:T℃时小于250℃时 |
| C.其他条件不变,若减小容器体积,CO体积分数增大 |
| D.a<0,平衡常数K:T℃时大于250℃ |
下列各组离子能在溶液中大量共存的是
| A.Na+、OH-、HS-、NO3- | B.AlO2-、K+、CO32-、Na+ |
| C.Al3+、Cl-、HCO3-、Na+ | D.Fe2+、K+、H+、NO3- |