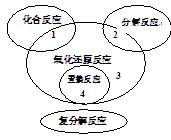
氧化还原反应与四种基本反应类型关系如图,下列化学反应属于区域3的是
| A.Zn+H2SO4==ZnSO4+H2↑ |
B.3CO+Fe2O3 2Fe+3CO2 2Fe+3CO2 |
| C.CaO+H2O==Ca(OH)2 |
D.CaCO3 CaO+CO2↑ CaO+CO2↑ |
下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )。
| A.加热Al2O3 | B.加热HgO |
| C.电解熔融NaCl | D.铝粉和Fe2O3共热 |
我国古代的湿法冶金术是世界闻名的。我国在世界上最先应用湿法冶金术冶炼出来的金属是( )。
| A.Fe | B.Cu | C.Ag | D.Hg |
用铝热法还原下列氧化物,制得金属各1 mol,消耗铝最少的是( )。
| A.MnO2 | B.WO3 | C.Cr2O3 | D.Co3O4 |
铝用来焊接钢轨是利用( )。
| A.铝同氧气反应生成稳定的保护层 |
| B.铝是热的良导体 |
| C.铝是强还原剂,铝热反应放热 |
| D.铝合金强度大 |
下列金属一般用电解熔融盐的方法冶炼的是( )。
| A.活动性强的金属 | B.活动性弱的金属 |
| C.人类较早使用的金属 | D.明代作货币的金属 |