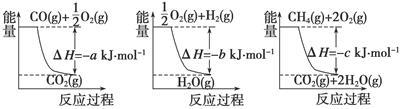
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式: 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的正极电极反应式是__________________。
(4)利用右图装置可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。
假设海水中只有NaCl溶质,写出此时总离子反应方程式:
②若X为锌,开关K置于M处,该电化学防护法称为 。写出铁电极处的电极反应式:____________。
(10分)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为。
(2)元素N、P、S的第一电离能(I1)由大到小的顺序为。
(3)HN3属于晶体,与N3-互为等电子体的分子的化学式(写1种)NH2-的电子式为,其中心原子的杂化类型是。
(4)CuCl2-中的键型为,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为。
(5)治癌药物B的结构简式为。
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。元素Y基态原子的3p轨道上有5个电子。元素Z的原子最外层电子数是其内层的3倍。元素W基态原子核外电子共有16种运动状态。
(1)①在元素周期表中,元素Y位于第周期第族,元素X位于区;
②Z所在周期中,第一电离能最大的元素是(填元素名称);
③X+的核外电子排布式为;
④Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是(填化学式)。
(2)X与Y所形成化合物晶体的晶胞如图所示。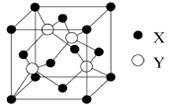
①在1个晶胞中,X离子的数目为。
②该化合物的化学式为。
(3)X与W的最高价含氧酸的浓溶液反应的化学方程式为。
A、B、C三种物质的分子式都是C7H8O,若滴入FeCl3溶液,只有C呈紫色,且C苯环上的一溴代物有两种结构。若投入金属钠,只有B没有变化。
(1)写出A、B、C的结构简式:A__________,B__________,C__________。
(2)C的同一类中另外两种同分异构体的结构简式是①__________,②__________。
维生素C的结构简式为 ,有关它的叙述错误的是
,有关它的叙述错误的是
| A.是一个环状的酯类化合物 | B.易起氧化及加成反应 |
| C.可以溶解于水 | D.在碱性溶液中能稳定地存在 |
写出K3PO4 溶液中存在的物料守恒关系式___________________。