碘与氢气反应的热化学方程式是
①I2(g) + H2(g) 2HI(g) △H=-9.48 kJ·mol-1
2HI(g) △H=-9.48 kJ·mol-1
②I2(s) + H2(g) 2HI(g) △H=" +26.48" kJ·mol-1
2HI(g) △H=" +26.48" kJ·mol-1
下列说法正确的是
| A.②的反应物总能量比①的反应物总能量低 |
| B.I2(s) = I2(g) △H=" +17.00" kJ·mol-1 |
| C.①的产物比②的产物稳定 |
| D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ |
下列溶液肯定呈酸性的是
| A.含H+的溶液 | B.加酚酞显无色的溶液 |
| C.pH<7的溶液 | D.c(OH―) <c(H+)的溶液 |
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。下列叙述正确的是
CH3CH2OH(g)+3H2O(g)。下列叙述正确的是
| A.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态 |
| B.当平衡向正方向移动时,平衡常数一定增大 |
| C.增大压强,可提高CO2和H2的转化率 |
| D.相同条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量 |
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
| A.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1 |
| B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率不相等 |
| D.c1∶c2=3∶1 |
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是
| 纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
| A |
盐酸 |
玻璃 |
硫酸 |
氨水 |
干冰 |
| B |
氢氧化钡 |
蔗糖溶液 |
硫酸钡 |
醋酸 |
水 |
| C |
胆矾 |
浓硫酸 |
氧化钙 |
水 |
二氧化碳 |
| D |
硝酸 |
盐酸 |
硫酸 |
醋酸 |
氢气 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ/mol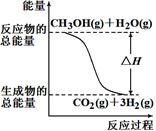
根据上述反应,下列说法正确的是
| A.反应①中的能量变化如图所示 |
| B.可推知2H2(g)+O2(g)=2H2O(g)ΔH=-483.8 kJ/mol |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.CH3OH转变成H2的过程一定要吸收能量 |