下列曲线中,可以描述乙酸(甲,Ka=1.8×10‾5)和一氯乙酸(乙,Ka=1.4×10‾3)在水中的电离度与浓度关系的是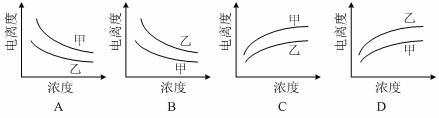
下列说法中,正确的是
| A.AgCl悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)<Ksp(AgI) |
| B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 |
| C.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大 |
| D.强电解质的水溶液中不存在分子 |
向20 mL 0.1 mol·L-1氨水中逐滴加入0.1mol·L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示。下列说法正确的是
A.在D点:c(NH4+)+c(NH3·H2O)>c(Cl-)
B.在C点,有V1>10,且c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.由B到C的过程中,c(NH4+)/c(NH3·H2O)先增大后减小
在Na2S溶液中,下列关系不正确的是
| A.c(Na+)=2c(HS—)+2c(S2—)+c(H2S) |
| B.c(Na+)+c(H+)=c(OH—)+c(HS—)+2c(S2—) |
| C.c(Na+)>c(S2—)>c(OH>c(HS—) |
| D.c(OH—)=c(HS—)+c(H+)+2c(H2S) |
常温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa混合液,溶液显酸性,则溶液中粒子浓度:c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-)
B.浓度均为0.1 mol·L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3)
C.将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
下列关于0.1 mol·L-1 NH4Cl溶液的说法正确的是
| A.向溶液中加滴加几滴浓盐酸,c(NH4+)减少 |
| B.向溶液中加入少量CH3COONa固体,c(NH4+)减少 |
| C.溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.向溶液中加适量氨水使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |