下列说法正确的是
| A.熔点:Na-K合金<Na<氯化钠 |
| B.非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 |
| C.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
| D.同一原子中,2p、3p、4p能级的轨道数依次增多 |
己烷雌酚的一种合成路线如下: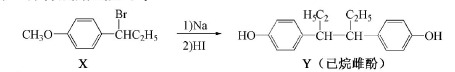
下列叙述不正确的是
| A.在NaOH水溶液中加热,X可发生消去反应 |
| B.在一定条件,Y可与HCHO发生缩聚反应 |
| C.用FeCl3溶液可鉴别X和Y |
| D.X中所有碳原子可能共面,Y中所有碳原子不能共面 |
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是
| A.Br2的CCl4溶液 | B.[Ag(NH3)2]OH溶液 |
| C.HBr | D.H2 |
分子式为C4H8O3的有机物,在一定条件下具有下列性质:
①在浓硫酸作用下,能分别与CH3CH2OH和CH3COOH发生酯化反应;
②在浓硫酸作用下也能脱水生成一种只存在一种结构形式,且能使溴水褪色的物质;
③在浓硫酸存在下,也能生成一种分子式为C4H6O2的无支链环状化合物。
根据上述性质,确定C4H8O3的结构简式为
| A.HOCH2COOCH2CH3 | B.CH3CH(OH)CH2COOH |
| C.HOCH2CH2CH2COOH | D.CH3CH2CH(OH)COOH |
由乙醇制取乙二酸乙二酯,最简便的流程途径顺序正确的是
①取代反应②加成反应③氧化反应④还原反应⑤消去反应⑥酯化反应⑦中和反应⑧缩聚反应
| A.⑤②①③⑥ | B.①②③④⑤⑦ | C.⑤②①③⑧ | D.①②⑤③⑥ |
下列说法正确的是
| A.丙氨酸与苯丙氨酸脱水,最多可以生成3种二肽 |
B.对苯二甲酸( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( ) ) |
C.迷迭香酸的结构为 它可以发生酯化、水解、加成、取代、氧化等反应 它可以发生酯化、水解、加成、取代、氧化等反应 |
| D.分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 |