工业上用闪锌矿(主要成分是ZnS、FeS)冶炼锌,主要流程如下:

(1)焙烧炉中,ZnS转化为ZnO.补全该反应的化学方程式.
2ZnS+3 2ZnO+2SO 2
(2)酸浸槽中,硫酸与锌焙砂反应得到用于电解的酸浸液,反应过程中国需不断搅拌,其目的是 .
(3)酸浸渣的主要成分是铁酸锌(ZnFe 2O 4,其中Fe为+3价),底吹炉中,主要发生如下反应:
①3ZnFe 2O 4+C 2Fe 3O 4+3ZnO+CO↑
②ZnFe 2O 4+CO 2FeO+ZnO+CO 2
③ZnO+CO Zn(蒸汽)+CO 2
反应①﹣③中,化合价发生改变的元素有 .
(4)最终可以获得锌的设备有 .
下图甲是氢气和氧化铜反应的实验,下图乙是木炭和氧化铁反应的实验.

(1)、在上述两个实验中,氢气和木炭表现出相同的化学性质是性.
(2)、实验步骤的先后次序非常重要,比如甲实验中,反应前 必须先通氢气后点燃酒精灯,否则易发生爆炸;反应结束后必须先后,否则生成的红色的铜会变成黑色.
必须先通氢气后点燃酒精灯,否则易发生爆炸;反应结束后必须先后,否则生成的红色的铜会变成黑色.
(3)、某同学正确操作做完乙实验后,发现澄清石灰水变浑浊,试管中粉末全部变为黑色,取少量黑色粉末,加入足量稀硫酸充分振荡,但她惊讶地发现黑色粉末没有溶解,试管中也未产生预期的气泡,这说明该反应并没有生成(4)、该同学查阅资料,得到关于铁的氧化物如下信息:
根据以上信息,试写出乙实验试管中反应的化学方程式经分析后,该同学试着提高反应温度后,实验出现了预期的现象.
为了减轻酸雨的危害,我国研发了"海水法烟气脱硫工艺".其工艺流程大致是:
I、从高处喷淋下的海水(pH=8.1﹣8.3)洗脱从下而上燃煤烟气中的
,(
是弱酸),海水变为弱酸性;
Ⅱ、.将洗过烟气后的海水与氧气充分接触,发生下列反应:
III.再将与氧气充分接触的海水跟大量天然海水混合等措施,使各项指标接近天然海水后再排放.
(1)、在坐标图中画出"海水法烟气脱硫工艺"全过程中海水的pH依次变化大致趋势.
(2)、工艺流程中天然海水接触烟气后变为弱酸性,这说明在此过程中海水中的离子和
电离出的氢离子发生了反应.
(3)、若要测定海水中
含量,实验操作步骤是:
取少量被测海水,测定、加入足量的溶液(写化学式)、再加入稀硝酸、过滤、洗涤、烘干、称量沉淀质量.
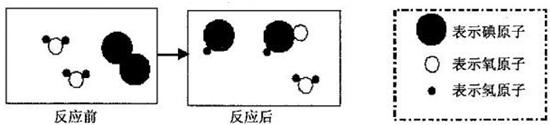
日本福岛核电站发生事故以来,目前在我国各地监测出的人工放射物质碘-131(碘元素符号: )的数值水平极其微小,不会对人体造成任何影响.碘-131能与水发生化学反应,生成两种酸.写出全部反应物的化学式,写出全部生成物的化学式.
科学家正在研究用某些金属粉末来替代一部 分化石燃料.
分化石燃料.
从燃烧的角度看,金属燃烧是指在一定的条件下,金属单质与氧气发生反应,放出大量的热.请写出一种金属燃烧的一个化学方程式.
被称为“绿色氧化剂”的过氧化氢(H2O2)俗称双氧水,是一种无色液
体,常用做氧化剂、消毒剂和漂白剂。过氧化氢溶液在二氧化锰做催化剂的条件下能迅速分
解,生成氧气;分液漏斗可以通过调节活塞控制液体的滴加速度。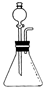
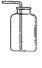
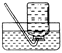
A B C D
回答下列问题:
(1)分液漏斗中应加入的物质是;锥形瓶中应放入的物质是。
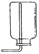
(2)写出利用该方法制取氧气的反应的文字表达式:;要想收集一瓶纯净的氧气,最好选择装置(填字母)。
(3)某同学在观察到锥形瓶内有大量气泡时,开始用C装置收集氧气,过了一段时间后,将带火星的木条伸入瓶口、瓶中和瓶底,都未见木条复燃。其原因可能是。
(4)如果在实验室中用此方法代替加热高锰酸钾制取氧气,请简述其优点有哪些。(至少写出两点);。
(5)小路同学用过氧化氢制取并收集了两瓶氧气,准备做硫粉燃烧和铁丝燃烧的实验,他在瓶底都加了少量水。请你来想一想,加水的目的分别是什么?
;。