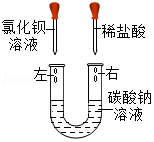
某化学活动小组在一次实验中进行如图所示实验:
此时观察到U型管左右两侧产生的现象分别是 ;实验后,小组同学充分振荡U型管,发现管内仍有白色固体残留,将混合物过滤后,同学们对滤液成分产生了浓厚的兴趣,于是进行了进一步的探究活动。
【提出问题】:滤液中可能含有哪些溶质?
【猜想与假设】猜想一:溶质为NaCl
猜想二:溶质为NaCl和BaCl 2
猜想三:溶质为NaCl、BaCl 2和HCl
【评价与交流】:你认为以上猜想 不合理,理由是 ;则你的猜想为 ;
【实验探究】小红为了验证滤液成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此得出结论:猜想一成立,小刚认为小红的结论不严密,因为 。
为验证你的猜想请填写如表
实验过程 |
实验现象 |
实验结论 |
|
|
你的猜想成立 |
【归纳与总结】:通过上述实验我们能够总结出:在确定化学反应后所得溶液中溶质成分时,除了考虑生成物外,还要考虑 。
为方便推测某些复杂物质的化学性质,可将其化学式改用常见物质的化学式表示。如碱式碳酸铜[Cu2(OH)2CO3]可改为Cu(OH)2•CuCO3,推测其兼具Cu(OH)2和CuCO3的化学性质。
(1)举重运动员常用碱式碳酸镁[Mg2(OH)2CO3]粉末抹在手掌以增大摩擦力。
①参照上述方法,碱式碳酸镁的化学式可改写为 。
②该物质兼具 (填“酸”或“碱”)和碳酸盐的化学性质。
③该物质分解的化学方程式为Mg2(OH)2CO3 2X+H2O+CO2↑,X的化学式为 。
2X+H2O+CO2↑,X的化学式为 。
(2)某种茶垢清洁剂的主要成分为过碳酸钠(可表示为2Na2CO3•3H2O2)。将过碳酸钠溶解于热水中,有大量气泡产生,其原因是 ;当不再产生气泡后,往溶液中加入足量澄清石灰水,反应的化学方程式为 。
用如图实验验证CO2的性质。
(1)实验室制取CO2的化学方程式为 。
(2)观察到短蜡烛熄灭后,关闭K,片刻后长蜡烛熄灭,由此得到的结论是 。
(3)观察到纸花变红,由此并不能得出“CO2能与水发生化学反应”的结论,理由是 。

用如图实验验证可燃物燃烧的条件,已知:白磷的着火点为40℃。

(1)实验1,能验证可燃物燃烧需要O2的现象是 。
(2)实验2,①中纸片燃烧,②中纸片未燃烧,②中纸片未燃烧的原因是 。
用如图装置研究酸、碱的性质。
(1)向1中滴加Na2CO3溶液,观察到的现象是 。
(2)向2、3中滴加无色酚酞溶液,溶液变红的是 (填序号);再向3中滴加NaOH溶液,NaOH与盐酸反应的化学方程式为 。

如图是去除粗盐中难溶性杂质实验的三步操作。

(1)三步操作的正确顺序是 (填序号)。
(2)B中,用璃棒不断搅拌的目的是 。