某兴趣小组在实验室用硫酸铜溶液和氢氧化钠溶液制取少量氢氧化铜固体。他们的实验过程和相关数据如图所示。请计算:

(1)生成沉淀的质量为 g。
(2)恰好完全反应后所得溶液的溶质质量分数。
(7分)某同学在参加学校开展的综合实践活动中,考察了一家化工厂的污水处理情况。该同学考察过程中收集到以下资料:
(1)该化工厂排放的污水中主要成分是盐酸,提取未经处理的污水水样l000g,加入含4 gNaOH的溶液恰好完全反应(废水中其它成分不与氢氧化钠、氢氧化钙反应),该废水中氯化氢的质量分数为_________(本空结果精确到0.001%)。
(2)该化工厂污水处理的步骤之一是:将100t污水排入中和池中进行中和处理,所用原料是较经济的氢氧化钙,请计算处理100t这种污水需要氢氧化钙的质量是多少吨?
医生给病人输液时,常用葡萄糖注射液。下图为葡萄糖注射液的部分标签图,根据下图回答下列问题:
(1)葡萄糖的化学式为 ,一瓶这样的葡萄糖注射液中含碳_____________g。
,一瓶这样的葡萄糖注射液中含碳_____________g。
(2)每克葡萄糖完全氧化约放出17.2kJ的能量,一瓶这样的葡萄糖注射液可放出_____________kJ的能量。
(3)现要配制10kg这种葡萄糖注射液,需用葡萄糖__________________________kg。
用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示。求:
(1)该纯碱样品中碳酸钠的质量分数。(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数。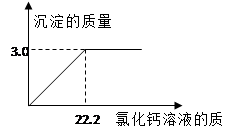
苏丹红是一种人工合成的红色染料。最新研究表明,其体内代谢产物有强致突变性和致癌性,国家正在严查添加有苏丹红的食品。已知最常见的一种苏丹红的化学式为C16H12N2O,试计算:
(1)苏丹红的相对分子质量;
(2)苏丹红中各元素的质量比;
(3)苏丹红中氮元素的质量分数。
孔雀石的主要成分为碱式碳酸铜[Cu2 (OH) 2CO3],化学小组的同学利用 Cu2 (OH) 2CO3+4HCl="2" CuCl2+CO2↑+3H2O,测定某孔雀石中碱式碳酸铜的质量分数。称取该铜矿样品30g于烧杯中,逐滴加入溶质质量分数为10%的稀盐酸至恰好完全反应,共用去稀盐酸146g(假设铜矿中的其他成分不与稀盐酸反应,也不溶于水)。则该孔雀石样品中碱式碳酸铜的质量分数是多少?反应后所得溶液中溶质的质量分数是多少?