小红称取5.0g某品牌化肥(商标如图1)于烧杯中,加水完全溶解,滴入Ba(OH) 2溶液进行该化肥中(NH 4) 2SO 4含量的测定(杂质溶于水但不参加反应)。测定数据如表和图2所示。

滴入Ba(OH) 2溶液质量/g |
50 |
100 |
150 |
200 |
生成沉淀质量/g |
2.33 |
4.66 |
6.99 |
m |
已知:(NH 4) 2SO 4+Ba(OH) 2═BaSO 4↓+2NH 3↑+2H 2O
(1)表格中的m、坐标上的a数值分别为 、 ;
(2)该化肥属于 (填"合格"或"不合格")产品
(3)计算所用Ba(OH) 2溶液中溶质的质量分数(写出计算过程,结果精确至0.01%)。
如图所示,有人制作了一个家庭制氧装置。该制氧装置由2个饮料瓶、2根软管和药剂构成,整套装置成本不到3块钱。药剂包括过氧碳酸钠(2Na2CO3?3H2O2)和二氧化锰。制氧时,先在两个饮料瓶中加入适量的水,再往甲瓶中加入药剂,产生的气体通过B管从乙瓶导出,即可供人吸氧。
(1)为了顺利地导出甲瓶中产生的氧气,A软管在甲瓶中应_____________。
(选填“不伸入液面”或“伸入液面”)
(2)药剂加入水中后会发生以下两个反应:
2Na2CO3?3H2O2 =" 2Na2CO3+3H2O2" ;2H2O2 2H2O+O2↑
2H2O+O2↑
从化学反应的基本类型来看,它们都属于______________反应。
(3)已知总质量为110克的药剂可产生34克过氧化氢,则这包药剂完全反应会生成多少克氧气?
国家规定,酿造食醋的总酸含量标准为3.5-5.0/100mL(总酸含量即100 mL食醋中含醋酸的质量)。某兴趣小组为测定一市售的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(醋酸和氢氧化钠反应的化学方程式:CH3COOH+NaOH=CH3COONa+H2O假设该市售食醋样品中其他物质不与氢氧化钠发生反应)
100g含碳酸钙90%的大理石与足量的稀盐酸充分反应( 反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑),试计算生成二氧化碳的体积。(已知二氧化碳的密度为1.8g/ml)相关原子质量Ca-40;C-12;O-16
反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑),试计算生成二氧化碳的体积。(已知二氧化碳的密度为1.8g/ml)相关原子质量Ca-40;C-12;O-16
在烧杯中加入2.14g表面被氧化的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如右图所示。请回答下列问题:
(1) 产生氢气g,
(2) 所滴加的稀硫酸中溶质的质量分数。
(3) 铝箔中铝元素的质量。
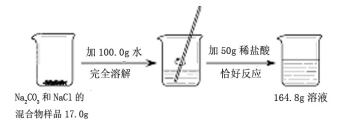
请根据下图所示的实验过程和提供的数据,计算样品中钠元素的质量。(提示
①氯化钠与盐酸不反应②二氧化碳溶于水的质量忽略不计)