我国制碱工业采用联合制碱法生产纯碱,其反应原理如下:
NaCl+NH 3+H 2O+CO 2═NaHCO 3↓+NH 4Cl 2NaHCO 3  Na 2CO 3+H 2O+CO 2↑
Na 2CO 3+H 2O+CO 2↑
【资料阅读】
①通常情况下,浓氨水具有较强的挥发性,易挥发出氨气。氨气是一种无色有刺激性气味的气体,极易溶于水,排放到空气中会污染空气。
②饱和碳酸氢钠溶液不能吸收二氧化碳。
化学兴趣小组在实验室模拟联合制碱法进行了如下实验:

Ⅰ.关闭K 1,先打开K 2通入NH 3,调节气流速率,待其稳定后,再打开K 1通入CO 2。
Ⅱ.待三颈烧瓶内出现较多固体时,关闭K 2停止通入NH 3;一段时间后,关闭K 1停止通入CO 2。
Ⅲ.将三颈烧瓶内反应后的混合物过滤,将滤出的固体洗涤、低温干燥,得到碳酸氢钠固体。再将其加热使其完全分解即得纯碱。
请回答下列问题。
(1)写出A装置中反应的化学方程式 。
(2)B装置中饱和碳酸氢钠溶液的作用是 。
(3)D装置中生石灰的作用是 。
(4)C装置中长颈漏斗的作用除了随时添加饱和食盐水,还有 作用。有同学认为应该在长颈漏斗内放置浸有稀硫酸的棉花团,其目的是 。
(5)关闭K 2停止通入NH 3,还要继续通入一段时间CO 2,其目的是 。
(6)写出副产品氯化铵和熟石灰反应的化学方程式 。
化学是以实验为基础的科学,实验是科学探究的重要手段。某化学兴趣小组在一次活动中进行了如图所示的探究实验。
【实验探究】

【收集证据】A烧杯中发生反应的化学方程式(1) 。根据C试管中的现象能得出B烧杯的溶液中一定没有的离子是(2) (填符号)。滴加氢氧化钡溶液的实验现象(3) 。
【结论应用】通过上述实验现象可以得出,在此过程中(4) (从宏观角度回答)。根据这个结论,若向C试管溶液中加入氯化钡溶液有白色沉淀产生,则B烧杯的溶液中一定含有的离子是(5) (填符号)。
【归纳总结】经讨论我们能够总结出,根据明显的实验现象可以得出许多结论。一般来说,常根据(6) ,证明物质发生了化学变化。
如图中A、B、C、D、E、F分别表示初中化学常见的六种物质,B、C、D、E分别属于酸、碱、盐、氧化物四种类别中的一种,A是目前提取量最大的金属,B由两种元素组成,C是大理石的主要成分。(图中用“﹣”表示两种物质之间能发生化学反应,用“→”或“ ”表示一种物质能转化为另一种物质,部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)。请回答下列问题。
”表示一种物质能转化为另一种物质,部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)。请回答下列问题。
(1)分别写出A、C、E、F物质的化学式
A C E F 。
(2)写出B与C发生反应的化学方程式 。
(3)写出过量A的粉末与B发生反应的实验现象 。

实验室现有石灰石、稀盐酸、火柴、药匙、升降台、木条、棉花、镊子及以下仪器:

(1)若要制取二氧化碳,应选择的仪器有①锥形瓶和 (填序号),还需补充的仪器是 (填名称)

(2)若补充一种药品还能制取氧气,发生反应的化学方程式为 。
(3)将制取氧气和检验氧气的装置图补充完整。
(4)用排水法收集氧气,当观察到导管口 时,开始收集,气体逸出的原因是由于试管内温度升高且 ,使试管内压强 ,大于外界大气压,在压强差的作用下,气体逸出。
小杨往NaOH溶液中滴加稀硫酸,溶液无明显变化,他和小组同学以“酸与碱能否发生反应”为课题进行了科学探究,请回答下列问题。
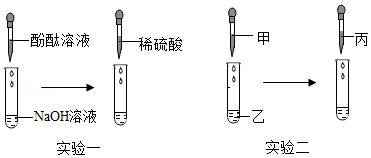
【实验一】
(1)向NaOH溶液中先滴入几滴酚酞溶液,振荡,再滴入稀硫酸,观察到溶液由 色变为无色,该反应的化学方程式为 。
(2)继续往上述试管逐滴滴入NaOH溶液,不断振荡,如果观察到 现象,证明了滴加的稀硫酸过量。
【实验二】按照“证明反应后NaOH消失了”这个角度,同学们又设计了实验二,利用NaOH溶液、CuSO4溶液、稀盐酸同样证明了酸和碱能发生反应,其中试剂丙是 。
【拓展延伸】CO2通入NaOH溶液中也无明显现象,CO2与NaOH溶液能否发生化学反应呢?小组同学对此继续探究。
【查阅资料】常温下NaOH、Na2CO3在水、乙醇中的溶解性如下表所示:
|
溶质 溶解性 溶剂 |
氢氧化钠 |
碳酸钠 |
|
水 |
极易溶 |
易溶 |
|
乙醇 |
易溶 |
微溶 |
【实验三】
小组同学设计了多角度验证CO2与NaOH溶液反应的实验,如实验三图所示(装置已连接好,气密性良好,止水夹a和b已关闭,部分仪器已略去)。
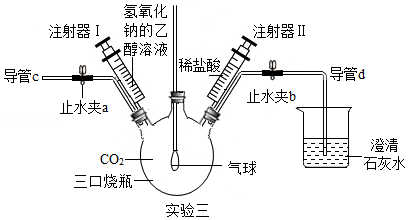
【温馨提示】CO2与乙醇不反应,本实验条件下CO2在乙醇中的溶解忽略不计。
(1)把注射器Ⅰ中氢氧化钠的乙醇溶液注入充满CO2的三口烧瓶中,轻轻振荡,观察到的现象是 。
写出该反应的化学方程式 。
(2)把导管d移出石灰水,打开止水夹a、b,再从导管C端往三口烧瓶中鼓入N2,目的是 。过了一段时间后,先把导管d放入澄清石灰水中,接着关闭止水夹a,再把注射器Ⅱ中的稀盐酸注入三口烧瓶内,观察到三口烧瓶中产生气泡,烧杯中的澄清石灰水变浑浊。此实验从 角度证明了CO2与NaOH溶液发生了反应。
【总结归纳】对于无明显现象的反应,可以通过改变实验装置,创设新的情境,观察到明显的反应现象,从而判断反应的发生。
根据如图回答问题。

(1)A中仪器①的名称是 ,发生反应的化学方程式是 。
(2)B中木条变黑,说明浓硫酸具有 性。
(3)C中会出现明显现象的是试管 (填序号),试管Ⅱ中的蒸馏水需要煮沸、迅速冷却后再使用,目的是 。