如图是元素周期表中1﹣18号元素的原子结构示意图,请回答下列问题:
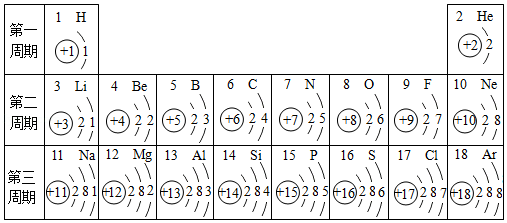
(1)原子序数为17的元素属于 (填“金属”或“非金属”)元素,表中与该元素化学性质相似的元素是 (填元素名称)。
3+和氖原子的核外电子排布相同,则X的元素符号是 。
(3)同一周期,从左到右,各元素原子的 依次递增。
以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl.(已知NH4HCO3在40℃受热易分解)
回答下列问题:
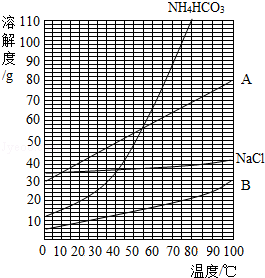
(1)该反应中的甲种物质溶解度曲线如图所示:
①35℃时,比较A、B溶解度的大小;A B.(填“<”或“>”).
②图中表示NaHCO3溶解度曲线的是 .(填“A”或“B”).
(2)为探究NaHCO3析出的最佳条件,完成了如图几组实验:
|
实验序号 |
反应温度/℃ |
反应时间/min |
NaHCO3产率/% |
|
a |
30 |
60 |
86.8 |
|
b |
30 |
120 |
X |
|
c |
35 |
60 |
89.4 |
|
d |
35 |
120 |
92.5 |
|
e |
40 |
60 |
85.3 |
|
f |
40 |
120 |
85.6 |
①实验c和d的目的是 .
②表格中X的数值可能为 .
A、85.8 B、86.8 C、92.1 D、93.1
③在相同反应时间,40℃时NaHCO3的产率比35℃时低的原因是 .
保险粉(化学式为Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定,在NaCl存在下,Na2S2O4在水中溶解度显著下降.制备流程如图:

(1)反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,该反应类型为 .
(2)反应Ⅱ为复分解反应,该反应的化学方程式为 .
(3)操作a的名称为 .
(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出还需要加入少量NaOH的原因是 ,加入NaCl的原因是 .
(5)198gZn(OH)2理论上能得到Zn的质量为 g.
实验室有4种试剂,分别为HNO3溶液、CuSO4溶液、MgCl2溶液和KOH溶液。
(1)有颜色的试剂是 。
(2)有一种试剂能与另外三种试剂发生反应,该试剂是 。
(3)书写化学方程式:
①CuSO4溶液与KOH溶液混合: 。
②HNO3溶液与NaHCO3溶液混合: 。
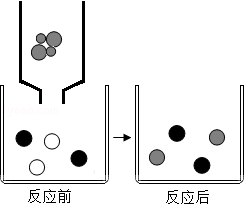
向滴有几滴酚酞的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为 。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子。(填离子符号)
 ;
; ;
;
(3)氨水(NH3•H2O)也能使酚酞变色,原因是氨水和氢氧化钠溶液中均含有一种相同离子,该离子是 。(填离子符号)
制笔行业中经常用到铂、钌(Ru)等贵金属,现有5种含钌元素的物质:Ru、RuO2、Ru2O3、RuCl3、K2RuO4.回答下列问题:
(1)RuO2读作 .
(2)上述5种物质中钌元素的化合价一共有 种.
(3)从物质分类角度看,K2RuO4属于 (填选项)
A、化合物 B、氧化物 C、碱 D、盐
(4)H2与Ru2O3在加热条件下反应可得到Ru,写出反应的化学方程式 .