习近平总书记多次强调"绿水青山就是金山银山"。水是生命之源。
(1)生活中采用 的方法,将硬水转化为软水。
(2)常用的净水方法有吸附、沉降、过滤、蒸馏等,其中净水程度最高的是 ;能够除去水中异味的物质是 (填名称)。
(3)请写出一条防治水体污染的措施 。
(4)请写出在生活中节约用水的一种做法 。
试用“分子”、“原子”或“元素”回答:
(1)酒精易挥发,这表明酒精在作扩散运动,由液态变成气态,表明酒精间的距离变大了。
(2)氧保持着氧气的化学性质。铁保持铁单质的化学性质。
(3)下图是某个化学反应的微观模拟示意图。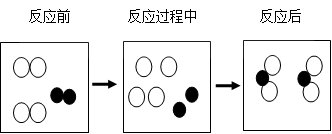
 表示一种原子,
表示一种原子, 表示另一种原子
表示另一种原子
据图比较分析,化学反应前后的种类和数目不变,的种类改变。
在宏观、微观和符号之间建立联系是化学学科的特点。
(1)食醋中的主要成分是醋酸(CH3COOH)、水和氯化钠。以上三种物质中共有种元素。其中醋酸中碳元素与氧元素的质量比为,1个醋酸分子中含有氢原子的个数为,氯化钠是由阴离子和阳离子结合成的,其中阴离子符号为。
(2)根据原子结构示意图判断,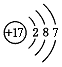
该元素的原子的核电荷数为,在化学反应中这种原子容易得个电子,形成氯离子。
(3)根据下表中元素和根的化合价,写出下列物质的化学式。
| 元素和原子团的符号 |
Fe |
O |
CO3 |
| 化合价 |
+3 |
-2 |
-2 |
氧化铁,碳酸钠。
(4)在描述水的组成和结构时,可以表述为:
①水是由氢元素和氧元素组成的;②水是由大量的水分子构成的;
③每1个水分子是由2个氢原子和1个氧原子构成的。
分析上述三句话:物质的宏观组成对应的是,物质的微观结构对应的是。
在生产生活中,你会发现“化学就在身边”。请完成下列填空:
⑴ 在符号 ①Fe2+②2NH3③NO2④2Na+中,“2”的意义各不相同。其中(用序号回答):
A、表示分子个数的是;B、表示一个分子中所含的原子数目的是;
C、表示离子数目的是;D、表示离子所带电荷数的是。
⑵ 用化学符号回答:
A、人体内含量最多的物质; B、空气中含量最多的气体;
C、地壳中含量最多的金属元素;D、相对分子质量最小的氧化物。
⑶写出下列反应的表达式:
① 剧烈燃烧,火星四射,生成黑色固体的反应;
② 二氧化碳与水发生的化合反应;
③ 能证明水是由氢、氧元素组成的化合反应
:
根据右列装置图回答问题
(1)写出图中标号的仪器称: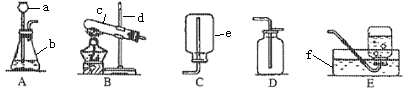
ab cd
e f
(2)请用A、B、C、D、E填空:
制取二氧化碳选用,收集CO2选择。
(3)请写出用大理石和稀盐酸反应制取二氧化碳的文字表达式或符号表达式:
某校研究性学习小组到实验室进行探究实验。他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质。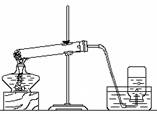
(1)写出用该方法制取氧气的文字表达式或符号表达式
______ _______________ _。
(2)他们所用的装置图中共有处错误。
(3)收集满氧气后,应用玻璃片盖住集气瓶口,并___ ___(填“正放”或“倒放” )在桌上。
(4)他们用这种方法收集了两瓶气体。在先收集的一瓶插入带火星的木条,只看到火星亮了一些,插入后收集的一瓶木条则能复燃。导致这个现象的可能的原因是(写出操作上的原因):______________________________________。