我们已经学过实验室制取气体的一般思路和方法,请根据如图装置回答相关问题:

(1)写出图中仪器①的名称: 。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,该反应的化学方程式是 ;收集较纯净的氧气应选择的装置是 (填字母序号);B装置中长颈漏斗下端管口必须伸入液面以下的原因是 。
(3)氨气是一种无色气体,密度比空气小,极易溶于水,有刺激性气味,污染环境。加热氯化铵和熟石灰的固体混合物可制取氨气,实验室制取并收集氨气,所选装置的接口从左到右正确的连接顺序为 。
某化学兴趣小组研究影响化学反应快慢的因素。
(1)下图是实验室中常用的仪器

①仪器A的名称是_______。
②从上图中选择合适的仪器组装一套 发生装置,要求添加盐酸无需拆开装置,需要用到的仪器有哪些?_______(填标号)
(2)该小组的实验设计和数据记录如下表。每个实验均在反应开始后,就立即用排水法连续收集多瓶 ,表中“—”表示气泡太少,不再收集。
|
序号 |
反应物 |
收集每瓶气体所用时间(单位:秒) |
|||||||
|
盐酸 浓度 |
盐酸 体积 |
大理石 形状 |
第1瓶 |
第2瓶 |
第3瓶 |
第4瓶 |
第5瓶 |
第6瓶 |
|
|
实验1 |
|
|
小颗粒 |
|
|
|
|
|
|
|
实验2 |
块状 |
|
|
|
|
|
|
||
|
实验3 |
|
|
小颗粒 |
|
|
|
|
|
|
|
实验4 |
块状 |
|
|
|
|
|
|
||
|
实验5 |
|
|
小颗粒 |
|
|
|
|
|
— |
|
实验6 |
块状 |
|
|
|
— |
— |
— |
||
①该小组研究了哪些因素对反应快慢的影响?_______
②为了分析浓度对反应快慢的影响,可对比表中实验_______(填标号)。
| A. |
|
B. |
|
C. |
|
D. |
|
③根据实验数据反映出的规律,表中数值 的合理范围是:_______< <_______。
(3)该小组在反应开始后立即收集第1瓶气体,你认为该做法合理吗?说出你的观点并阐述理由。__。
镓( )及其化合物应用广泛,常用于半导体、合金、磁性材料等领域。已知镓在化合物中常为 价,金属活动性顺序: 。
(1)镓的氧化物的化学式为_______。
(2)氢氧化镓是难溶于水的白色固体。
①上述信息中能用于推测氢氧化镓化学性质的是_______(填标号)。
| A. |
“氢氧化镓” |
B. |
“难溶于水” |
C. |
“白色固体” |
②取少量氢氧化镓固体于试管中,加入无色溶液X,充分振荡后固体完全溶解。溶液 可能是____或______。(填化学式)
(3)设计金属镓转化为氢氧化镓的一种方案:_______(依次写出化学方程式)。
某兴趣小组用氯酸钾和二氧化锰制取氧气。可能用到实验装置如图所示:

请回答下列问题:
(1) 仪器的名称_____。
(2)写出用该方法制取氧气的化学方程式_______________,其中二氧化锰的作用是_____,制取并收集干燥的氧气应选用_____(填实验装置图字母序号)。
(3)氯酸钾完全分解后,为了回收二氧化锰和氯化钾,又进行了如下实验操作:

实验操作中,操作①的名称是_____;实验操作②应选择上述图中的_____(填实验装置图字母序号)。
(4)实验结束后,同学们在拆卸装置时闻到刺激性气味。他们将回收得到的 称量,发现其质量小于加热前 的质量。查阅资料后发现,加热 和 混合物的反应过程如下:
第一步:

第二步:

第三步:

拆卸装置时闻到刺激性气味的气体是_____,根据以上信息写出加热后剩余固体中 质量小于加热前 质量的原因_______________。
某同学欲用 固体配制溶质质量分数为 的 溶液 ,用于制作“叶脉书签”。回答下列问题:
(1)为完成实验,除下列仪器外,还须用到的仪器(如图1)名称是_____。

(2)该同学称量 固体质量之前,先用托盘天平称量烧杯的质量。称量时,他把烧杯和砝码的位置放反了,天平平衡后,砝码的总和是 ,游码的位置如图2所示,则烧杯的实际质量为_____ 。
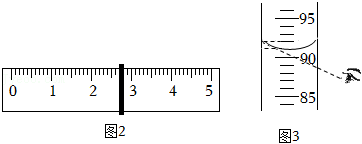
(3)该同学用 量筒量取实验所用的蒸馏水,读数视线如图3所示,量筒中水的实际体积为_____ ;若其他操作均正确,该同学所配 溶液中溶质的质量分数 _____(填“>”“<”或“=”) 。(水的密度为 )
(4) 溶液长时间露置于空气中会变质生成 ,发生反应的化学方程式为 _______________;实验室里用于盛装 溶液的试剂瓶是____________________(填“带磨口玻璃塞的广口瓶”或“带橡胶塞的细口瓶”)。
(5)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要先用大量的水冲洗,再涂上_____溶液。
实验室欲用 溶液制备氧气,并进行铁丝在氧气里燃烧的实验。回答下列问题:
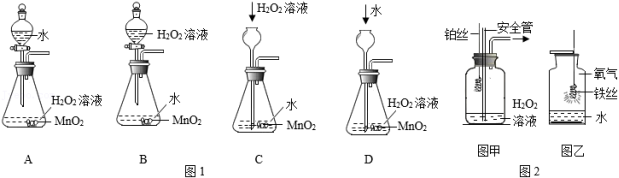
(1)若用溶质质量分数为 的 溶液和 制备氧气,反应速率太快。为获得平稳的气流,下列发生装置(如图1)最合适的是_____(填标号);发生反应的化学方程式为_______________。
(2)已知:用 制取氧气时,也可用铂丝代替 作催化剂。如图2中甲装置可通过铂丝的上下移动控制反应的发生与停止,若制备过程中体系内压强过大,则安全管中的现象是__________,此时应将铂丝抽离过氧化氢溶液,使反应停止。
(3)用图2中乙装置进行铁丝在氧气里燃烧的实验,可观察到的现象是____________________;反应的化学方程式为_______________。