硫酸铵[(NH4)2SO4]和氯化钾直接作为肥料使用会影响某些作物的生长,工业上往往将氯化钾转化为无氯钾肥.如图是硫酸铵、氯化铵、氯化钾、硫酸钾等四种盐的溶解度曲线.回答下列问题:
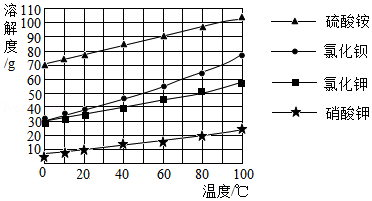
(1)根据图示,四种盐的溶解度﹣﹣温度曲线变化规律是:
① ;②温度相同时, .
(2)20℃时,将10g KCl加入20g水中,充分搅拌,KCl未完全溶解,应该至少加热至 ℃以上KCl才能完全溶解.
(3)在(NH4)2SO4 热饱和溶液中加入氯化钾立即析出无氯钾肥晶体.根据溶解度曲线判断:无氯钾肥的化学式是 .
下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答: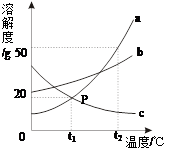
温度为时,a与c两物质的溶解度相等;在三物质中,物质(填序号)的溶解能力受温度影响最大。
(2)t2℃时,35ga物质加入到50g水中不断搅拌,形成的溶液质量是_________g;
(3)t2℃时,用100g水与一定质量a物质恰好配成饱和溶液。若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g。
(4)在t2℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是_________。
下图A是某元素在元素周期表中的相关信息,B是其原子结构示意图。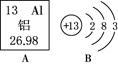
(1) 该元素属于 元素;(填 “金属”或“非金属”);
(2) 该原子在化学反应中容易(填“得”或“失”)电子,变成阳离子,该离子的符号为。
现有H、O、Na、S、C五种元素,请从中选择合适的元素,按要求书写化学式。
(1)一种金属氧化物;(2)一种盐;
(3)一种碱;(4)一种气体单质。
新药帕拉米韦注射液可用于治疗H7N9禽流感,其说明书中部分内容如图。
(1)帕拉米韦由种元素组成,其中氢、氮的原子个数比为。
(2)帕拉米韦中氧元素的质量分数是(精确到0.1%)
根据如下图所示装置,结合所学知识回答下列问题。
(1)写出图中仪器①的名称;
(2)实验室用A装置制取氧气,写出反应的化学方程式;
(3)实验室制取二氧化碳应选用的发生装置是,要写出反的化学方程式:;
(4)实验室用B、E、C装置制取并收集干燥的氧气,则E中应盛放的试剂是;
(5)实验室用D装置收集氧气,当时开始收集。