某铁矿粉,主要成分为铁的氧化物(FexOy),一学生利用实验作进一步分析,过程及数据如下.(注:铁矿粉中杂质不参与下列过程中的反应)
ⅰ.取29g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g
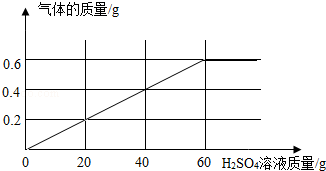
ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图:
通过计算回答下列问题:
(1)过程ⅰ中生成气体的质量 g,过程ⅱ中固体充分反应后,产生气体的质量为 g.
(2)所用稀硫酸溶液的溶质质量分数为 .
(3)29g铁矿粉所含铁的氧化物中,铁元素的质量为 g,氧元素的质量为 g.
(4)该铁的氧化物化学式中,x、y的最简整数比x:y= .
过氧化钠(化学式为Na2O2)是一种淡黄色的固体物质,它能与水发生化学反应,其反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑,现将一定质量的过氧化钠加入到盛有175.2g氢氧化钠溶液的烧杯中,反应完毕后称得溶液的质量比反应前过氧化钠和水的总质量减少了6.4g,所得溶液中溶质的质量分数为20%,试计算:
(1)反应生成氧气的质量是g。
(2)烧杯中的氢氧化钠溶液中溶质的质量分数。
氮化铝(AlN)被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应制得:Al2O3+N2+3C═2AlN+3CO,现欲制备12.3t氮化铝,需要参加反应的氧化铝(Al2O3)质量是多少?
徐州某钢铁厂用赤铁矿炼铁。现欲生产含杂质4%的生铁583t,至少要采购含氧化铁80%的赤铁矿石多少吨?(计算过程中结果均保留整数)
从海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)中氯化镁先转化为氢氧化镁沉淀从而过滤出来,然后用盐酸与氢氧化镁反应转化为氯化镁,再结晶析出。
计算理论上溶解5.8g氢氧化镁需要7.3%HCl溶液多少克?(相关反应化学方程式:Mg(OH)2 + 2HCl = MgCl2 + 2H2O )
高速电气化铁路的建设需要大量的铁矿石。某化学兴趣小组取得铁路建设所用的赤铁矿石样品(含Fe2O3和杂质,杂质不溶于水且不参加化学反应)20g,将其置于烧杯中,向其中加入84g稀盐酸,反应原理为:Fe2O3+6HCl=2FeCl3+3H2O,二者恰好反应,反应后过滤,得到滤渣4g。
求:(1)赤铁矿石中Fe2O3的质量分数;
(2)滤液中溶质的质量分数。