研究小组对氯水(氯气的水溶液)进行探究.
(1)测定氯水的酸性:取少量,向其中滴加(选填指示字母) ,一开始应观察到滴加的指示剂在氯水中 色.
a.无色酚酞试液 b.紫色石蕊试液
(2)氯水具有漂白性,请你参与"氯水使品红试纸褪色"的研究.
【提出问题】氯水中的什么成分使品红试纸褪色?
【猜想】
猜想1:氯水中的水使品红试纸褪色.
猜想2:氯水中的Cl 2使品红试纸褪色.
猜想3:氯水中的HCl使品红试纸褪色.
猜想4:氯水中的 (填化学式)使品红试纸褪色.
【实验探究】
实验操作 |
实验现象 |
结论 |
①用水润湿品红试纸,观察 |
|
猜想1不成立 |
②把品红试纸放入干燥的氯气中,观察 |
试纸不褪色 |
猜想2不成立 |
③ ,观察 |
试纸不褪色 |
猜想3不成立 |
【结论】通过探究,找到了氯水中使水使品红试纸褪色的原因.
【思考】实验(1)向氯水中滴加几滴所选指示剂后,最终观察到的现象是 .
某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色.请看图回答问题:
(1)A中反应的化学方程式 ;B中白磷不燃烧,原因是 .
(2)C、D中看到的现象分别是 、 .
(3)用化学方程式表示E中颜色变化的原因 ;用F装置收集气体的依据是 .
同学们在实验室用5%的H2O2溶液制取氧气并进行氧气性质实验。
溶液配制:用50ml 30%的H2O2溶液制取氧气(密度为1.13g/cm3)配制5%的H2O2溶液(密度约为1g/cm3)。溶液配制过程中,除用到玻璃棒外还需用到下列仪器中的_____________。
| A.托盘天平 |
| B.烧杯 |
| C.漏斗 |
| D.量筒 |
E.胶头滴管
气体制备:用配制好的5%H2O2溶液和MnO2制取O2。请你在“A”、“B”两套装置中选择其中一套,并说明选择的理由_____________________,该反应的化学方程式为________________________。待反应结束后同学们回收了混合物中的MnO2,实验操作为____________________。
性质实验:小明用收集好的氧气,进行了下面的实验:
把点燃的木炭伸入集气瓶中,实验现象是_______________________;为使铁丝在氧气中持续剧烈燃烧,他把光亮的细铁丝盘成螺旋状,_____________________________________,缓慢插入集气瓶中,观察到持续剧烈燃烧。通过实验得出,氧气可以支持燃烧,并且可燃物燃烧更剧烈。
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序.
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合弹的方案,如图l所示: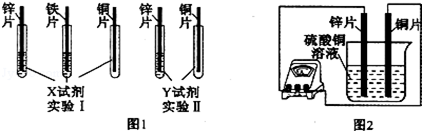
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现青色.
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至 色,最终变为无色;
B.向混合注中插人锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
② ;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表 ;②铜片表面 .
(2013湖北宜昌)二氧化硫是造成酸雨的主要物质之一。小丽为探究二氧化硫能与水反应生成酸,设计了如下实验方案。
【实验设计】她先用紫色石蕊溶液将白色滤纸浸润,干燥后做成紫色的小花,然后按下列图示进行实验。观察到实验(Ⅰ)和(Ⅲ)中的小花变红,(Ⅱ)中的小花不变色。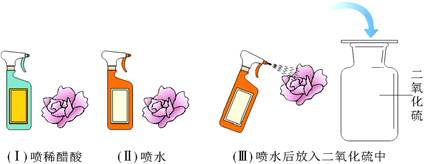
【评价反思】小虎对小丽的实验方案提出了质疑,他认为上述实验还不足以证明“二氧化硫和水反应生成了酸”。两位同学仔细讨论后认为还需补充如下一个实验,才能得出二氧化硫与水反应生成酸。
| 实验操作 |
实验现象 |
| |
【拓展应用】二氧化硫也是实验室一种污染气体,常用碱液吸收。写出实验室用氢氧化钠溶液吸收二氧化硫的化学方程式: 。
【2014年贵州省黔东南州市】学习了CO2的有关知识后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2═2MgO+C,所以镁着火不能来CO2来灭火,但没有找到有关Na能否与CO2反应的介绍.于是同学们展开了钠着火能否用CO2来灭火的探究.
【提出猜想】钠能发生类似于CO2与镁的反应,可能的化学方程式为_________ .
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在集气瓶中继续燃烧.
进一步【查阅资料】得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,也能与H2O反应生成NaOH.
②Ba(OH)2溶于而BaCO3不溶于水.
③Na2CO3的存在会干扰NaOH的检测.
基于以上资料,同学们认为钠在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
Ⅰ.Na2O、C;Ⅱ_________ 、C;Ⅲ.NaOH、C;Ⅳ.Na2O、Na2CO3、C
通过理论分析,猜想_________ (填序号)肯定错误的,理由是_________
【验证猜想】
| 步骤 |
实验操作 |
主要实验现象 |
结论(燃烧产物判断) |
| (1) |
将产物溶于适量水中 |
部分溶解,试管底部有黑色固体 |
燃烧产物中肯定有C |
| (2) |
取少量(1)所得上层溶液,加入过量的BaCl2溶液 |
_________ |
燃烧产物中肯定有Na2CO3 |
| (3) |
取少量(2)所得上层清液,加入_________ 溶液 |
有蓝色沉淀生成 |
燃烧产物中肯定有_________ |
在步骤(2)中BaCl2溶液为什么要加入至过量?其原因是:_________ .
【结论】猜想_________ (填序号)是正确的.