无论在化学世界里,还是在日常生活中,酸是广泛存在而又非常重要的物质。下面对常见的酸﹣硫酸的部分性质进行探究。

(1)浓硫酸的特性
①向一个烧杯中加入一定质量的浓硫酸,总质量为m 1;敞口放置在空气中一段时间后,总质量为m 2,那么m 1 m 2(选填(选填">、"="、"<")。
②如图2所示,将水滴入装有浓硫酸的锥形瓶中(锥形瓶和木板用熔化的石蜡粘在一起),观察到液滴四溅。据此图2分析,下列关于浓硫酸的叙述正确的是
A.稀释浓硫酸时,一定要将浓硫酸缓慢注入水中
B.稀释浓硫酸时,一定要将水缓慢注入浓硫酸中
C.浓硫酸充分溶于水后,可以将锥形瓶从木板上轻轻提高
(2)与金属反应
向装有镁、铁,铜的A、B、C三只试管中(如图2),分别加入等质量等质量分数的稀硫酸,不能观察到明显现象的是 (填序号);请写出反应最剧烈的试管中发生反应的化学方程式 。
(3)与非金属反应
将冷的浓硫酸加入到装有碳粉的圆底烧瓶中,无明显现象:加热该混合物、有大量气泡产生,现对导出的气体成分进行验证。
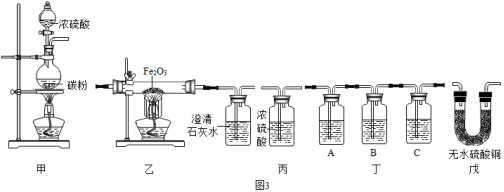
【查阅资料】
①碳与浓硫酸在加热时,除了生成水之外,还生成二氧化硫和碳的一种氧化物;
②二氧化硫和二氧化碳都能使澄清石灰水变浑浊,其中,二氧化硫还能使紫红色的酸性高锰酸钾溶液褪色。
【实验验证】某化学兴趣小组在老师指导下设计了如图3实验装置进行验证。
温馨提示:丁装置的A、B、C中均装有紫红色的酸性高锰酸钾溶液
①为了完成对导出气体的验证,请将上述装置进行正确的连接:
甲→ → →丙 (填序号,此小题2分)
②请完成如表中的相关内容:
实验现象 |
实验结论 |
乙中观察到的现象 |
证明碳与浓硫酸加热反应生成碳的氧化物是二氧化碳而不是一氧化碳 |
丁装置A中溶液褪色 丁装置C中溶液不褪色 |
证明气体中有 装置C的作用 |
戊中白色固体变蓝 |
证明气体中有水蒸气 |
【获得结论】碳与浓硫酸加热反应的化学方程式 。
中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
(1)下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的 (填甲或乙)图所示进行的。
②曲线上M点表示 。
(2)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:根据下图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应。乙同学认为:甲同学得出这个结论的依据不科学,理由是 。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、
D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,
再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 |
A |
B |
C |
D |
E |
| 盐酸的溶质质量分数 |
5% |
10% |
15% |
20% |
25% |
| 反应后溶液温度(℃) |
24℃ |
34℃ |
46℃ |
54℃ |
54℃ |
实验结论:影响中和反应放出热量多少的因素 。
交流反思:反应后,烧杯内溶液pH最小的是 (填烧杯编号)。
在化学实验室,小刚和小强意外发现实验桌上有一瓶敞口放置的氢氧化钠固体,他们对这瓶氢氧化钠固体是否变质进行了如下实验探究:
【提出问题】这瓶氢氧化钠固体是否变质?
氢氧化钠露置在空气中会发生变质.变质的原因是(用化学方程式表示).
【实验探究】为检验这瓶氢氧化钠固体是否变质,小刚和小强设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质.
小强:取少量样品加适量蒸馏水配成溶液后,滴入适量澄清石灰水,若观察到有白色沉淀生成,证明该瓶氢氧化钠固体已经变质.
你认为上述实验方案错误的是 .理由是 .
请你设计另外一个方案,证明该瓶氢氧化钠固体已经变质,并完成以下实验报告:
| 实验步骤 |
实验现象及结论 |
【交流反思】在实验室里氢氧化钠需要密封保存.药品密封保存的原因很多,请你写出浓硫酸需要密封保存的原因 .
某兴趣小组同学在实验室将一定量的稀硫酸加入到盛有氢氧化钠溶液的烧杯中,未看到明显的现象.部分同学产生疑问:酸和碱到底能否发生反应?
(1)该小组同学又做了如下实验:
| 实验步骤 |
实验现象 |
实验结论及反应方程式 |
| 向滴有酚酞溶液的稀氢氧化钠溶液的试管中,加入稀硫酸,并振荡 |
观察到溶液由 色变为无色. |
氢氧化钠和硫酸发生了反应.反应的化学方程式为 . |
(2)同学们对(1)实验后溶液中的溶质组成展开探究,做出如下猜想:
小明的猜想是:只有Na2SO4;
小亮的猜想是:有Na2SO4和NaOH;
小丽的猜想是:有Na2SO4和H2SO4;
你认为 的猜想不合理.理由是 .
若要验证余下两种猜想中的一种是正确的,请完成下面的实验方案.
| 实验步骤 |
预期实验现象 |
实验结论 |
| 取(1)实验后溶液少量于试管中,加入 |
的猜想正确 |
(2013陕西)小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成。他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究。
【提出问题】反应后溶液中溶质的成为是什么?
【猜想假设】
猜想①Na2SO4、Na2CO3
猜想②Na2SO4、Na2CO3、NaOH
猜想③Na2SO4、H2SO4、Na2CO3
猜想④Na2SO4、 H2SO4
猜想⑤Na2SO4
上述猜想中,你认为不合理的是猜想__(填序号)。
【实验探究】(1)小鹏取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,据此,他认为猜想⑤是正确的。你认为他的结论是__(填“合理”或“不合理”)的,理由是 。
(2)小明向盛有少量氧化铜粉末的试管中加入适量该溶液,振荡,溶液变蓝。该反应的化学方程式是 。
【实验结论】根据上述实验探究,你认为猜想___(填序号)是正确的。
【拓展应用】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是 (答一点即可)。
【2014年广西省南宁市】某碳酸钾固体样品,可能含有硫酸钾、碳酸钙、硫酸铜、氯化钾、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:
①取少量样品溶于水得到无色溶液,然后滴加过量的氯化钡溶液,出现白色沉淀A,过滤.
②沉淀A中加入过量的稀硝酸,沉淀部分消失并放出气体.往步骤①所得的滤液中加入适量硝酸银溶液和稀硝酸,生成白色沉淀B,过滤.回答下列问题:
(1)白色沉淀B是 ,步骤②中放出的气体是 .
(2)杂质中一定含有 ,一定没有 .
(3)最终所得滤液中含有的阳离子是 .