实验室用40克含碳酸钙75%的石灰石样品与足量的稀盐酸混合制取二氧化碳(化学反应方程式为:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑)。
求:
(l)40克石灰石样品中含碳酸钙 克;
(2)充分反应后,理论上可制得二氧化碳多少克?(要求:结合化学方程式计算,并写出计算过程)
在一定量的氢氧化钠稀溶液中逐渐滴加溶质质量分数毒.0.73%的稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:
| 反应时间(秒) |
0 |
25 |
50 |
75 |
100 |
125 |
150 |
175 |
200 |
| 滴入稀盐酸体积(毫升) |
0 |
4 |
8 |
12 |
16 |
20 |
24 |
28 |
32 |
| pH |
13.2 |
13.0 |
12.7 |
12.4 |
12.1 |
7.0 |
2.0 |
1.6 |
1.3 |
| 温度(℃) |
36.9 |
37.5 |
38.0 |
38.5 |
38.8 |
39.2 |
39.0 |
38.8 |
38.6 |
(1)观察上表发现,当反应时间在__________秒时,氢氧化钠与盐酸恰好中和。
(2)分析上表数据发现,在逐渐滴加稀盐酸的过程中,溶液的温度先升高后降低,请分析原因:________________。
(3)结合上表中滴入稀盐酸体积与pH的变化数据,试计算氢氧化钠稀溶液中溶质的质量。(稀盐酸的密度取l.0克/毫升;化学方程式为:NaOH+HCI=NaCl+H2O)
国家规定,酿造食醋的总酸含量标准为3.5-5.0/100mL(总酸含量即100 mL食醋中含醋酸的质量)。某兴趣小组为测定一市售的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(醋酸和氢氧化钠反应的化学方程式:CH3COOH+NaOH=CH3COONa+H2O假设该市售食醋样品中其他物质不与氢氧化钠发生反应)
用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示。求: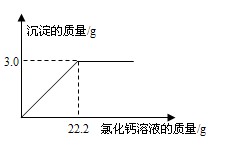
(1)该纯碱样品中碳酸钠的质量分数。(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数。
取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如下图所示,请根据题意解答问题:( )
(1)当加入196g稀硫酸时,放出气体的质量为g。
(2)计算加入的稀硫酸溶液溶质的质量分数为 。
(3)试通过计算求出加入98g稀硫酸(即A点)时烧杯中溶液溶质的质量分数。(写出计算过程)
某化学研究性学习小组为测定市场出售的食醋总酸量(国家规定食醋中总酸量3.5g/100mL~5g/100mL),拟配制一定质量分数的氢氧化钠溶液,然后进行测定。请你参与该小组的实验研究,并回答相关问题。
(1)配制100g质量分数为5%的氢氧化钠溶液需要水 mL(水的密度为1g/cm3)。
(2)若食醋中的酸均看成是醋酸,醋酸与氢氧化钠反应的方程式为:
CH3COOH + NaOH = CH3COONa + H2O 现有食醋500mL,甲同学从中取出10mL食醋,加入5%的氢氧 化钠溶液4.8g,恰好完全反应。请通过计算判断该食醋是否合格?(写出计算过程)
化钠溶液4.8g,恰好完全反应。请通过计算判断该食醋是否合格?(写出计算过程)