莫凡同学完成镁与稀盐酸反应的实验后,观察到有灰白色沉淀生成的"异常"现象,引起了他的兴趣,并进行了以下探究。
【初步探究】出现灰白色沉淀是否为偶然现象。
【实验Ⅰ】向4份相同体积与浓度的稀盐酸中分别加入一定长度的某种镁带,现象如下:
实验组别 |
A |
B |
C |
D |
镁带长度 |
1cm |
2cm |
3cm |
4cm |
沉淀量 |
无沉淀生成 |
少量沉淀 |
沉淀较多 |
沉淀很多 |
【实验结论】并非偶然,据表分析, 是实验出现"异常"的主要因素。
【再次探究】该沉淀的成分
【猜想假设】猜想1:Mg;猜想2:MgCl 2
【实验Ⅱ】
序号 |
实验操作 |
实验现象 |
实验结论 |
① |
取1g样品,加入足量 ,振荡 |
未见气泡 |
猜想1错误 |
② |
取1g样品,加入5mL蒸馏水,振荡 |
沉淀未溶解 |
猜想2错误 |
③ |
取1g MgCl 2固体,加5mL蒸馏水,振荡 |
固体全部溶解 |
【交流讨论】
(1)莫凡同学做出猜想Ⅰ的依据是他认为反应物Mg过量,作出猜想2的依据是他认为生成物MgCl 2 。
(2)从实验设计的角度讲,实验③的作用是 。
【深入探究】该沉淀的物质组成
【查阅资料】
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mg x(OH) yCl z•nH 2O[即每份Mg x(OH) yCl z结合了n份H 2O],它受热分解可产生氧化镁、氯化氢和水。
【实验Ⅲ】
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g。
【问题讨论】
(1)反应停止后,应继续通入N 2一段时间,目的是 。
(2)该沉淀中,镁、氯的离子个数比n(Mg 2+):n(Cl ﹣)= 。
(3)若沉淀Mg x(OH) yCl z•nH 2O中,n=5,则X、Y、Z的数值依次为 。

如图是实验室制取气体的相关装置,请回答下列问题。

(1)①仪器的名称是 。
(2)实验室用高锰酸钾制取氧气。若要收集一瓶较纯净的氧气,应选择的发生装置和收集装置是 (填装置对应的字母,下同)该反应的化学方程式是 ,反应的基本类型是 。
(3)实验室制取二氧化碳,应选择的发生装置是 。若用C装置收集二氧化碳气体,验满方法是 。
实验小组将澄清石灰水和碳酸钾溶液混合,充分反应后过滤,得到了滤液M,同学们对滤液M中溶质的成分进行探究,探究过程如下:
【猜想与假设】①含有KOH;②含有 ;
③含有KOH、K 2CO 3; ④含有KOH、K 2CO 3和Ca(OH) 2。
【设计与实验】
(1)大家认为猜想 一定不正确,其原因是 。
(2)甲同学取滤液M样品,向其中加入足量的 ,不产生气泡,则猜想③不正确。
(3)乙同学依据甲同学的实验结论继续实验,记录如下:
|
实验操作 |
现象 |
结论 |
|
取一定量滤液M于试管中,加入 溶液 |
|
猜想②成立 |
相关反应的化学方程式为 。
【交流与反思】
若将滤液M直接倒入下水道,对环境造成的影响是 。
化学是一门以实验为基础的科学,根据如图所示的实验,请回答下列问题。
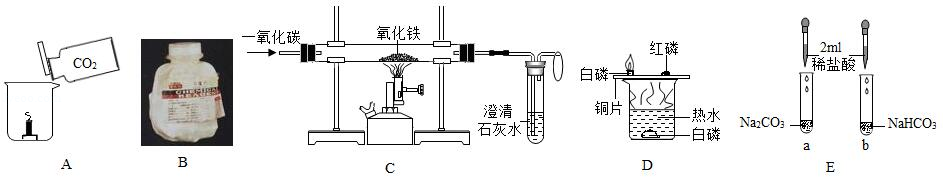
(1)A图烧杯中的短蜡烛熄灭,体现二氧化碳的物理性质是 ;
(2)B图中装满生石灰的塑料试剂瓶已经膨胀破裂,请用文字解释这一现象 ;
(3)C图玻璃管中的现象是 ,该现象体现了一氧化碳的性质是 ;
(4)D图所示铜片上的白磷燃烧,而红磷不燃烧,证明燃烧需要的条件之一是 ;
(5)E图中,A、B两试管中各盛有0.5g碳酸钠和碳酸氢钠,分别加入2mL等浓度的稀盐酸,观察到 (填"A"或"B")试管中的反应更迅速。
实验室制取气体时需要的一些装置如图所示,请回答下列问题。

(1)写出标有序号的仪器名称:① ;
(2)实验室用大理石和稀盐酸制取二氧化碳可选择的发生和收集装置为 (填字母序号),其反应的化学方程式为 ,该发生装置中使用分液漏斗的优点是 ;
(3)写出检验二氧化碳是否集满的操作方法 ;
(4)若用(2)中所选装置来制取干燥的氧气,还需要的装置为 (填字母序号)。
(5)某兴趣小组的同学用A、G、H装置进行实验,若实验时G装置中蜡烛燃烧更剧烈,H装置中的现象是 ,A装置中反应的化学方程式为 。
工业采用电解氯化钠溶液制备烧碱。某同学取电解后的溶液进行如下探究:
【提出问题】电解后的溶液中的溶质是什么?
【猜想假设】(1)NaOH、NaCl(2)NaOH
【实验探究】取电解后的溶液,进行如下实验:

【收集证据】实验1的反应现象为(1) ,实验2发生反应的化学方程式为(2) 。
【实验结论】电解后的溶液中的溶质是(3) 。
【表达交流】实验中滴加酚酞溶液的作用是(4) 。在滴加过量稀硝酸的过程中,图2中①表示的是(5) (填符号),②表示的是(6) (填符号)。
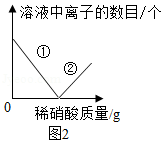
【总结规律】通过探究还可认识到:上述实验1和实验2的反应都是两种化合物在溶液中(7) 的形式,通过一种(8) 的方式而发生的复分解反应。