"84"消毒液在日常生活中使用广泛,具有漂白、杀菌、消毒功效。某化学兴趣小组对一瓶敞口久置的"84"消毒液成分产生兴趣,在老师的指导下,展开探究。
【提出问题】该敞口久置的消毒液中溶质有哪些?
【查阅资料】"84"消毒液主要成分是次氯酸钠(NaClO)和氯化钠,NaClO为有效成分,有腐蚀性并易与空气中CO 2反应(2NaClO+CO 2+H 2O═2HClO+Na 2CO 3)。NaClO溶液、HClO都具有漂泊、杀菌、消毒功效。HClO不稳定,受热或光照会发生分解。
【分析讨论】小组同学经过讨论,认为该消毒液中的溶质一定有 。可能还有NaClO、Na 2CO 3、HClO中的一种或多种。
【实验过程】Ⅰ:向装入有色布条的试管中加入适量该消毒液试样,布条长时间不褪色。
Ⅱ:另取适量该消毒液试样于试管中,加入足量氯化钙溶液,静置,观察到的现象为 。
【得出结论】实验过程Ⅰ中有色布条不褪色,说明该消毒液试样中的溶质不含 。实验过程Ⅱ中反应的化学方程式为 。综上所述,该消毒液试样中的溶质为 。
【交流反思】生活中,"84"消毒液贮藏时应注意 ;一般不要"84"消毒液对蔬菜、水果进行消毒,其原因可能是 。
【拓展延伸】(1)次氯酸钠与稀硫酸可发生复分解反应,化学方程式为
(2)次氯酸钠与盐酸反应可生成有毒的氯气,日常生活中"84"消毒液不能与洁厕灵(主要成分为盐酸)混合使用。
下列是化学实验常用仪器和收集气体装置,回答有关问题:

(1)请写出指定序号的仪器名称:A D
(2)在溶解固体时,C的作用是 ;用B量取液体,读数时视线要与凹液面的 处保持水平。
(3)实验室制取氧气时,用F装置收集氧气,这种收集气体的方法叫 法;不能用E装置收集氧气的原因是 。
化学是一门以实验为基础的学科。请结合下列图示回答问题

(1)图F中用于加热的仪器名称是 ,图A中用分液漏斗代替长颈漏斗的优点是 。
(2)CO和CO 2是初中化学中常见的气体,请写出实验室制取CO 2气体的化学方程式 。
(3)实验室常用草酸钠( Na 2C 2O 4)和硫酸反应来制取CO,反应的化学方程式为:Na 2C 2O 4+H 2SO 4=Na 2SO 4+CO↑+CO 2↑+H 2O,实验装置如图所示。从图中实验仪器中 (填装置的序号及现象)的现象可判断出生成的气体一定含有CO 2,实验仪器中 (填装置的序号及现象)的现象可判断出生成的气体一定含有CO.从环保的角度出发,上述实验装置需要改进的地方是 。
(4)液化石油气的主要成分是丁烷(C 4H 10),丁烷属于 (填"有机物"或"无机物")。丁烷燃烧不完全会有CO产生,CO会使人中毒,所以使用液化石油气时要特别小心,防止CO中毒。某厨房因使用不当,丁烷燃烧不完全生成了CO和CO 2,且CO和CO 2的质量比为56:44,请写出此时丁烷燃烧的化学方程式 。
根据下列实验装置回答下列问题

(1)写出图中仪器a的名称:
(2)实验室制取CO2的化学方程式为 ,采用的发生装置和收集装置是 (填字母序号)
(3)实验室常用亚硫酸钠和硫酸反应制取SO2,SO2是一种密度比空气大、易溶于水的有毒气体,若选择图F装置收集SO2,气体应从导管口 (填“b”或“c“)端进入,理由是 ,尾气必须要进行处理,其目的是 。
通过学习,你已经掌握了实验室制取气体的有关知识。请结合如图回答。

(1)仪器甲的名称是 。
(2)实验室加热高锰酸钾制取氧气应选用的发生装置为 (填字母),若选B装置作为实验室制取氧气的发生装置,反应的化学方程式为: ,某同学用D装置收集氧气,验满方法是 。
(3)实验室可用B或C装置制二氧化碳,选用C相对于B装置的主要优点是 。
(4)某同学用E、F装置收集一定量的氢气,装置接口连接的顺序为 (填接口字母),量筒的作用是 。
根据下列实验装置,回答问题
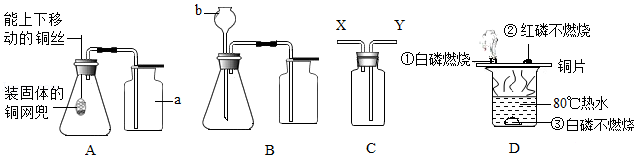
(1)写出仪器a、b的名称:a ,b 。
(2)装置A、B均可用于实验室制取二氧化碳,能使反应随时发生或停止的装置是 。若装置C的瓶内充满空气,正放在桌面收集O2,则气体应从 (填“X”或“Y”)端口进入。
(3)如装置D所示,由①、②的现象说明可燃物燃烧需满足的条件是 ;烧杯中热水所起的作用是 。