某兴趣小组设计如下实验探究质量守恒定律。

(1)如图甲,小柯将烧杯放在天平左盘,使天平重新平衡。然后取下烧杯把铁钉放入试管中,一段时间后,再把烧杯放回天平左盘,最后天平是否平衡? 。反应后试管内溶液的质量 (选填"增加"、"减少"或"不变")。
(2)如图乙,小妍将烧杯放在天平左盘,使天平重新平衡。然后倾斜烧杯使盐酸与石灰石粉末混合,一段时间后再把烧杯放回天平左盘,发现天平不再平衡。其原因是 。小柯对该实验装置进行改进,把烧杯换成锥形瓶(如图丙,装置气密性良好)。你认为能否验证质量守恒定律并阐述理由: 。
(3)小妍想测定实验所用石灰石中碳酸钙的质量分数,取6克石灰石粉末与足量的稀盐酸充分反应,反应后总质量减少2.2克。求石灰石中碳酸钙的质量分数(杂质与稀盐酸不反应)。(结果精确到0.1%)
下图是一种常见的补钙药,还有该药片的说明书。请仔细阅读后回答下列问题:
(1)该葡萄糖酸钙的相对分子质量为;
(2)该葡萄糖酸钙中钙元素的质量分数为;(保留为0.1%)
(3)如果每天服用葡萄糖酸钙12片,则含葡萄糖酸钙g,相当于补充g钙元素;
(4)如果改服用碳酸钙(CaCO3)来补充钙元素,则补充1g钙元素要服用碳酸钙g。
氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源。某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题: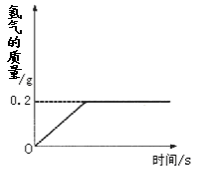
⑴氢化锂与水反应的化学方程式为:
LiH+H2O= +H2↑。
+H2↑。
则X的化学式为;
⑵.氢化锂中Li、H元素质量比为;
(3)反应过程中生成氢气的质量为_______g;
(4)取用氢化锂的质量为多少?
给29.4克氯酸钾和二氧化锰的混合物加热,测得剩余固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s |
t0 |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
| 反应后固体的质量m∕g |
29.4 |
27.4 |
25.4 |
23.4 |
21.4 |
19.8 |
19.8 |
请回答下列问题:
(1)当氯酸钾完全反应后,生成氧气的质量为g。
(2)剩余固体由哪些物质组成?它们的质量各为多少克?
硫酸亚铁(化学式为FeSO4)可用于治疗缺铁性贫血,根据硫酸亚铁的化学式计算:
(1)硫酸亚铁的相对分子质量为 。
(2)硫酸亚铁中铁、硫、氧三种元素的质量比(化成最简比)为 。
(3)硫酸亚铁中氧元素的质量分数(结果保留一位小数)。
(10分)老师要求同学们将30g NaCl样品中的杂质 除去,同时测出其中所含
除去,同时测出其中所含 的质量分数。提供的试剂有:一定质量分数的NaOH溶液、KOH溶液、稀盐酸各100g。小林同学顺利完成了任务。她的方法是:将30g NaCl样品加入100g水中,固体全部溶解后再逐渐加入所选试剂,当加入的试剂质量为56g时,恰好完全反应,测得生成沉淀的质量为4.9g。请回答:
的质量分数。提供的试剂有:一定质量分数的NaOH溶液、KOH溶液、稀盐酸各100g。小林同学顺利完成了任务。她的方法是:将30g NaCl样品加入100g水中,固体全部溶解后再逐渐加入所选试剂,当加入的试剂质量为56g时,恰好完全反应,测得生成沉淀的质量为4.9g。请回答:
(1)小林同学所选用的试剂是。
(2)该NaCl样品中 的质量分数是多少?
的质量分数是多少?
(3)当恰好完全反应时,所得溶液的质量是多少?