二氧化碳与二氧化硫均为非金属氧化物,某兴趣小组用类比法对SO 2进行如下探究:
探究一 二氧化硫和二氧化碳性质的比较
[查阅资料]二氧化硫具有漂白性,能与某些有色物质(如品红溶液)反应生成无色物质。

操作现象装置 |
实验Ⅰ:通入二氧化碳 |
实验Ⅱ:通入二氧化硫 |
A |
紫色变成红色 |
? |
B |
无明显变化 |
红色褪为无色 |
C |
白色浑浊 |
白色浑浊 |
由实验可知:
(1)将SO 2通入装置A中的现象为 说明二氧化硫也能与水反应生成相应的酸。
(2)二氧化碳能与澄清石灰水反应,生成亚硫酸钙(CaSO 3)和水,写出该反应的化学方程式 。
(3)鉴别CO 2和SO 2的方法是 。
(4)从环保角度指出上述装置的不足之处: 。
探究二 测定工业废气中的SO 2含量
[查阅资料]①二氧化硫与溴水反应的化学方程式为:Br 2+SO 2+2H 2O=H 2SO 4+2HBr
②我省规定工业排放的废气中SO 2含量不得超0.4mg/m 3。
探究小组进行如下实验
测定步骤:
Ⅰ.向试管中加入10mL溶质的质量分数为0.1%的溴水(其密度可近视看做1g/cm 3)
Ⅱ.在指定地点抽取工业废气注入上述溴水中(如图2)。
Ⅲ.当注入溴水中的工业废气总量达5m 3时,溶液恰好由黄色变成无色。
(1)由实验可知该废气中SO 2含量为 mg/m 3, (填"符合"或"不符合")排放标准(SO 2、Br 2的相对分子质量分别为:64、160)
(2)排放到空气中的SO 2气体主要来自 的燃烧。
书写下列化学反应的文字表达式(或符号表达式)并注明反应类型
(1)氢气燃烧 ()
(2)硫燃烧 ()
(3)铁在氧气中燃烧 ()
(4)加热氯酸钾与二氧化锰混合物 ()
实验室配制50g质量分数为20%的硝酸钾溶液,现有25g溶质质量分数为40%的硝酸钾溶液、20g溶质质量分数为15%的硝酸钾溶液及足量的硝酸钾固体和水,请选用上述药品设计三种配制方案,并填入下表:
| 配制方案(只要说明配制所需的各种药品及用量即可) |
|
| 方案一 |
|
| 方案二 |
|
| 方案三 |
下图是小华配制100g溶质质量分数为7.5%的NaCl溶液的实验操作示意图: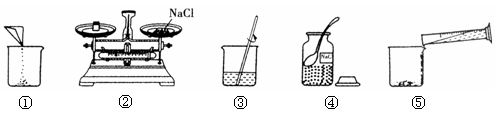
(1)上图中的玻璃仪器分别是广口瓶、量筒、 和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)指出图②中的一处错误操作 。
(3)通过计算确定需要水的质量是 g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。
(4)下列错误操作可能导致溶液溶质的质量分数小于7.5%的是_____________(填序号)
| A.②操作中食盐与砝码放置颠倒; |
| B.①操作中有固体洒落; |
| C.⑤操作中有水溅出; |
| D.读取量筒内液体体积于视线过低; |
E、装瓶存放操作中溶液洒落。
(5)该同学在称量氯化钠药品前天平的指针偏左,则所配制的溶液的质量分数 (填“偏大”“偏小”“不受影响”)
小明在实验室做加热硫酸铜晶体试验的过程中,试管炸裂,请你分析一下可能的原因。(至少两个原因)
(1) 。
(2) 。
正确的操作能保证实验顺利进行。请填写下列有关实验操作中的空格:
(1)用酒精灯给物质加热时,要用酒精灯火焰的_______________;
(2)给试管加热时,都要先要给试管______________,再加热;
(3)用量筒量取液体度数时,视线与___________保持水平。