(1)化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质(填化学式)实现Ca(OH) 2一步转化为CaCO 3。

(2)某Ca(OH) 2样品部分变质为CaCO 3(假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH) 2的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸 g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
反应时间/min |
0 |
t 1 |
t 2 |
t 3 |
烧杯总质量/g |
280.0 |
278.9 |
277.8 |
277.8 |
完全反应后,生成的CO 2气体的质量为 g。
③数据处理:计算该样品中Ca(OH) 2的质量分数(根据化学方程式的计算写出完整的计算步骤)。
化学实验室制取气体的部分仪器或装置如图所示,请回答下列问题。 
(1)仪器B的名称: 。
(2)若用氯酸钾和二氧化锰制取氧气,必须要增加的一种仪器是 ;该反应的化学方程式为: 。若用装置H收集氧气,氧气应从 (填"a"或"b")端通入。
(3)若要组装一台制取并收集二氧化碳气体的装置,可选择的装置组合为 (填字母,写一种组合即可)。
(4)某同学用上述(2)中的方法制取氧气,实验过程中试管发生了炸裂,请你帮他分析试管炸裂可能的原因是 。(写一条即可)
下列初中化学常见的几种物质相互转化关系图,其中B为黑色固体,N为蓝色沉淀,其中部分生成物和反应条件已略去。

请回答:
(1)D的化学式为 。
(2)B→A的化学方程式为 。
(3)C和F反应的化学方程式为 ,其基本反应类型为 。
2017年5月5日,我国国产大型客机C919在上海浦东机场首飞成功,标准着我国航空事业有了最大突破.结合所学知识回答下列问题:
(1)大型客机大量使用了铝锂合金、钛合金等,其原因是合金比纯金属具有 .
(2)空气中,铝比铁具有更好的抗腐蚀性.原因是 (用文字叙述).
(3)已知金属M和N能够发生如下反应:Fe+MCl2=M+FeCl2,N+FeCl2=Fe+NCl2,判断Fe、M、N三种金属的活动性由强到弱的顺序是 .
20℃时,将等质量的甲、乙两种固体分别加入盛有100g水的烧杯中,充分搅拌后现象如图1所示,甲、乙两物质的溶解度曲线如图2所示。请回答下列问题:
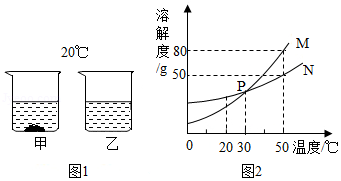
(1)图l中一定为饱和溶液的是 溶液(填“甲”或“乙”)
(2)图2中P点表示的意义 。
(3)图2中表示乙物质溶解度曲线的是 (填“M”或“N”)
用适当的化学用语填空
(1)2个氮气分子 ;(2)+5价的磷形成的氧化物
(3)硝酸中的阴离子 ;(4)常用于改良酸性土壤的碱 .