为了测定某石灰石样品中碳酸钙的含量,小敏同学取12.5g该样品进行实验,然后将100mL稀盐酸分五次加入该样品中,充分反应后测得每次生成气体的质量如下表所示(样品中的杂质不反应,生成的气体全部逸出)。
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
加入稀盐酸的体积/mL |
20 |
20 |
20 |
20 |
20 |
生成气体的质量/g |
1.1 |
1.1 |
1.1 |
1.1 |
0 |
请计算:
(1)生成气体的总质量是 g。
(2)碳酸钙(CaCO 3)的化学式量是 。
(3)该石灰石样品中碳酸钙的质量分数(写出计算过程)。
小洁同学为测定测定钙片中碳酸钙的含量标注是否属实(50%),她取出4片片剂(每片2.5克),研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0 g,称量烧杯中剩余物质量为47.8 g(不含烧杯质量, 假定钙片其它成分不与盐酸反应。)求:
(1) 生成二氧化碳的质量。
(2) 稀盐酸中溶质的质量分数。
(3) 通过计算判断钙片中碳酸钙的含量标注是否属实。
实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。请计算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体g。
(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体样品,全部溶于96. 6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。求: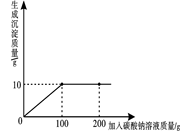
(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是g。
(2)样品中氯化钠的质量是多少?
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
某品牌补钙剂的主要成分是碳酸钙(杂质不含钙元素),向12g这种补钙剂样品中逐渐加入稀盐酸,盐酸质量和生成气体的质量如下表所示(杂质可溶于水,不和盐酸反应),第三次加入盐酸后,所得溶液中氯化钙的质量分数为20% 。求这份补钙剂含钙的质量分数。
| 第一次 |
第二次 |
第三次 |
|
| 加入稀盐酸的质量 |
18.25g |
36.5g |
47.9g |
| 生成气体的质量 |
2.2g |
4.4g |
4.4g |
(8分)某兴趣小组的同学为分析一种石灰石样品中碳酸钙的质量分数,取20g样品放入烧杯,把60g稀盐酸分三次加入烧杯,使其充分反应(样品中所含杂质既不溶于水也不与稀盐酸反应),实验流程及数据如下(所有实验数据都不包括烧杯的质量,且不考虑H2O和HCl的挥发;操作X包括搅拌、过滤、洗涤、干燥、称量):
请回答:
(1)CaCO3中Ca与C的质量比为;
(2)实验时判断已充分反应的现象是:其中a为g;样品中碳酸钙的质量分数为;
(3)第三次反应过滤后所得溶液的pH7(填“>”、“<”或“=”);为使该溶液
显中性且得到尽可能多的CaCl2,最后可向烧杯中加入过量的(填序号)
| A.CaO | B.CaCO3 | C.Ca(OH)2 | D.CaCl2 |
(4)计算所用稀盐酸中溶质的质量分数(写出计算过程)