经过“碱的化学性质”的学习,小明同学用如图所示的示意图归纳总结了NaOH的四条化学性质(即NaOH能与四类物质发生化学反应).
(1)为了验证反应②,小明同学将适量的紫色石蕊试液滴入NaOH溶液中,其观察到的现象是 .
(2)为了验证反应③能够发生,应选用下列的哪一种试剂 .
A.KNO3 B.NaCl C.CuSO4 D.Na2CO3
(3)NaOH溶液露置于空气中易变质,所以必须密封保存,请你写出NaOH溶液变质的化学方程式: .

请根据题目要求回答下列问题。
(1)使用托盘天平称未知某物品的质量正确操作顺序为(填序号) 。
①调游码 ②放称量纸 ③称量物放左盘
④调零点 ⑤加质量大的砝码 ⑥加质量小的砝码
A.①②③④⑤⑥B.④②③⑤⑥①C.④⑤⑥①②③
(2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为m2,则(填“=”“>”“<”)m1 m2,从微观角度解释出现这种现象的原因 。
(3)如图装置中,称量小烧杯中所有物质的质量为m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为m2,则(填“=”“>”“<”)m1 m2,原因是: 。
水是宝贵的自然资源,是人类生命之源。
(1)下列各种水中,属于纯净物的是 (填字母)。
| A.汽水 | B.矿泉水 |
| C.蒸馏水 | D.经过净化处理的自来水 |
(2)自来水厂常用二氧化氯(ClO2)消毒,其中氯元素的化合价为 ;
(3)小刚为了净化收集到的雨水,自制了一个如图所示的简易净水器,其中小卵石、石英沙和膨松棉的作用是 。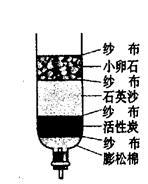
(4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。请写出Ca(HCO3)2受热分解的化学方程式: 。
(5)今年“中国水周”的主题是“节约保护水资源,大力建设生态文明",请列举一条生活中你的节水做法: 。
根据下图实验装置,回答下列问题。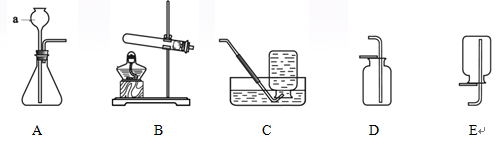
(1)仪器a的名称是 。
(2)实验室用高锰酸钾制备氧气,发生装置是 (填字母序号),反应的化学方程式是 。
(3)用A装置制备二氧化碳时,反应的化学方程式是 ,收集二氧化碳的装置是 (填字母序号),仪器a的下端必须伸入反应物液面以下形成“液封”,其原因是 。
从C、H、O、Ca四种元素中,选择适当元素,组成符合下列要求的化学符号填在横线上:
①石灰石的主要成分中阳离子的符号 ;
②固体可用于人工降雨的是 ;
③2 个“西气东输”的主要气体物质的分子 ;
④导致煤气中毒的物质中氧元素的化合价 。
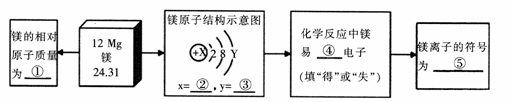
根据镁元素在元素周期表中的信息,将下图方框内①一⑤项内容补充完整: