某同学查阅资料得知,实验室常用电石(主要成分CaC2)与水反应制取乙炔(C2H2),反应的化学方程式为:CaC2+2H2O═Ca(OH)2+C2H2↑(电石中的杂质不溶于水且不与水反应,也不与Na2CO3反应)。在实验室中,该同学把一定量的CaC2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,并对滤液的成分进行探究。
[提出问题]:滤液中溶质的成分是什么?
[猜想与假设]:猜想一:NaOH、Na2CO3
猜想二:NaOH
猜想三:NaOH、Ca(OH)2
[分析与推理]:
分析一:若猜想一成立,说明实验中加入的CaC2量少,CaC2与水反应生成的Ca(OH)2与Na2CO3反应后,Na2CO3剩余。
分析二:若猜想二成立,说明实验中加入的CaC2与水反应生成的Ca(OH)2与Na2CO3恰好完全反应后。
分析三:若猜想三成立,说明实验中加入的CaC2量多,CaC2与水反应生成的Ca(OH)2与Na2CO3反应后,Ca(OH)2剩余。
由以上分析可推知:反应后滤液中一定存在的溶质是 (填化学式,下同),可能存在的溶质是 和 。对可能存在的溶质,需要进一步实验验证。
[设计并实验]
实验序号 |
实验操作 |
实验现象 |
实验结论 |
实验一 |
取少量滤液于试管中,向其中加入过量稀盐酸 |
无气泡产生 |
猜想 不成立 |
实验二 |
另取少量滤液于试管中,向其中滴入适量碳酸钠溶液 |
|
猜想三成立,发生反应的化学方程式为
|
[拓展延伸]
若向CuCl2溶液中加入少量CaC2,充分反应,可观察到有气泡产生,同时出现蓝色的 (填化学式)沉淀。实验室保存电石应注意 。
已知KNO3在20℃时的溶解度是31.6g,求此温度下将15.8g KNO3固体溶于水配成饱和溶液,需加水 克,所得溶液的溶质质量分数是 。
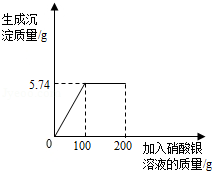
将含有可溶性杂质的某氯化镁样品3g溶于足量水中得到不饱和溶液,再向所得溶液中逐滴滴入200g一定溶质质量分数的AgNO3溶液(杂质不含镁元素且不与AgNO3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示:
试计算:
(1)恰好完全反应时生成沉淀质量为 g。
(2)样品中含镁元素的质量是多少?(结果精确到0.01g)
(3)原硝酸银溶液中溶质的质量分数是多少?(结果精确到0.1%)
氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的CaH2 加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
[提出问题]滤液中溶质的成分是什么?
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 。
[实验验证]
|
实验 |
现象 |
结论 |
|
(1)取少量滤液,向其中滴入少量碳酸钠溶液 |
无明显现象 |
猜想 不成立 |
|
(2)另取少量滤液,向其中加入足量稀盐酸 |
|
猜想三成立 |
[反思与拓展]
(1)写出氢化钙(CaH2)与水反应的化学方程式 。
(2)若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和 。
(3)登山运动员携带CaH2作为能源提供剂与携带氢气相比,其优点是 (写一条即可)。
实验室部分仪器或装置如图所示,请回答下列问题。
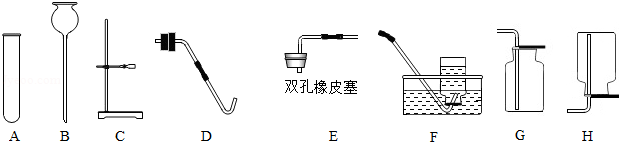
(1)若要组装一套实验室制取二氧化碳的发生和收集装置,可选择图中 (填仪器或装置的标号),实验室用该装置制取二氧化碳的化学方程式为 。
(2)若用高锰酸钾制取氧气,你认为还需要增加的玻璃仪器是 ;写出该反应的化学方程式: 。
Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
|
实验编号 |
① |
② |
③ |
④ |
|
NaOH溶液质量/g |
10.0 |
20.0 |
30.0 |
40.0 |
|
Mg(OH)2质量/g |
0.232 |
0.522 |
0.580 |
0.580 |
(1)实验 (填实验编号)中硫酸镁完全反应。
(2)计算100g混合溶液中含MgSO4的质量(写出计算过程)。
(3)分析实验数据,在图中,画出加入4% NaOH溶液质量0﹣30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。