为探究酸的性质,同学们设计了如下实验,请你参与。
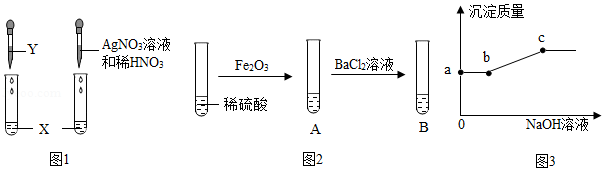
检验物质。按图1实验,可确定X是盐酸,则Y可以是 。
(1)确定溶质成分。由图2实验,A中固体全部溶解,B中有白色沉淀产生,得出结论:A中溶质只有硫酸铁。有同学认为该结论不合理。接着向试管B中滴加氢氧化钠溶液,且产生沉淀的量随氢氧化钠溶液量的关系如图3所示。则:A中溶质有 。实验中,A中发生反应的化学方程式为 ;a~b段对应溶液中一定发生反应的化学方程式为 ;c点对应溶液中含有溶质可能的组成有 。
(2)由以上实验总结酸的化学性质有 。
把一枚生锈的铁钉放入过量的稀盐酸中,首先可观察到的现象是________________,反应的化学方程式为________________;过一段时间后,又观察到铁钉表面有________产生,产生该现象的化学方程式为________________.
如下图所示,在蒸馏烧瓶内加适量石灰石和稀盐酸,经检验产生的气体充满烧瓶时,将一气球紧套在瓶口,气球逐渐胀大.然后打开弹簧夹,将注射器中NaOH溶液注入烧瓶并振荡,气球迅速缩小并被吸入烧瓶内.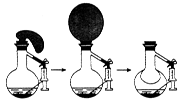
(1)检验产生的气体充满烧瓶的操作是________________________.
(2)气球被吸入烧瓶是由于NaOH溶液与瓶内气体反应,使瓶内气压________.该反应的化学方程式为________________________________________.
根据下图装置回答问题。
①仪器“a”的名称是.
②用装置A进行氯酸钾分解制取氧气的实验,还需补充的仪器是,化学方程式为。
③在A-D的发生装置部分,能随时控制反应发生和停止的是(填字母,下同),适合于实验室制取二氧化碳的装置是,二氧化碳气体的验满方法是。
④用双氧水与二氧化锰的混合物制取氧气能否使用装置D?理由是。
⑤现取一定质量的石灰石与足量稀盐酸充分反应,生成0.2mol二氧化碳。请计算:
Ⅰ.参加反应的碳酸钙的物质的量(根据化学方程式进行计算)
Ⅱ.上述实验中所取石灰石的质量可能为(填字母)。
| A.16.0g | B.20.0g | C.24.0g | D.26.0g |
用以下装置进行氢气、碳、一氧化碳还原氧化铜的实验并检验产物。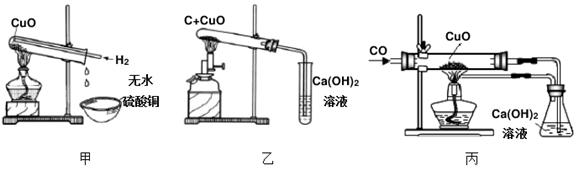
①上述装置都可观察到的现象是黑色固体变成色;
②用装置甲进行实验,要先通一会儿氢气再加热的原因是;
③装置乙中碳和氧化铜反应的化学方程式为;
④装置丙中的实验不能在装置甲中进行的原因是(仅答两点)。
人类的生产和生活都离不开水,2013年8月起,浦东居民全部喝上了青草沙优质水。
①在图1中,氯气的作用是,出厂水是(填“纯净物”或“混合物”)。
②图2的实验中,反应的化学方程式为,检验a管中气体的方法是。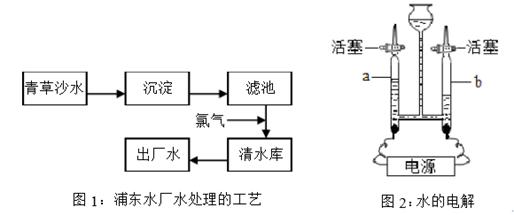
③青草沙水含氯化钠、氯化钾和硫酸锂等矿物质。
根据下图回答问题:
Ⅰ.随温度升高,硫酸锂溶解度的变化趋势是。
Ⅱ.40℃时,12g氯化钾固体溶于25g水中,成分搅拌,所得溶液的溶质质量分数为。
Ⅲ.上图中P点的含义是。
Ⅳ.分别将100g氯化钠、硫酸锂的饱和溶液从80℃降温至10℃,对所得溶液的叙述正确的是。
| A.两者均为饱和溶液 |
| B.溶液质量:氯化钠<硫酸锂 |
| C.溶剂质量:两者相等 |
| D.溶质质量分数:氯化钠>硫酸锂 |