某校九年级"我们爱化学"活动小组的同学,探究了过氧化钠(Na 2O 2)与二氧化硫(SO 2)反应后所得固体产物的成分,过程如下:
【查阅资料】过氧化钠与二氧化硫反应的化学方程式为:2SO 2+2Na 2O 2=2Na 2SO 3+O 2,2Na 2SO 3+O 2=2Na 2SO 4;SO 2能使品红溶液褪色。
【提出猜想】猜想1:固体成分为Na 2SO 3
猜想2:固体成分为Na 2SO 4
猜想3:
【实验探究】用如图所示的装置进行实验。打开A中分液漏斗的活塞,反应发生(产生足量的SO 2)后,用带火星的木条检验从a处导出的气体,木条复燃。实验前称得Na 2O 2固体的质量为78g,充分反应后称得生成物固体的质量为134g。
【实验结论】(1)A是制取SO 2气体的装置,反应的化学方程式与实验室制取CO 2的化学方程式类似,请写出A中发生反应的化学方程式: 。
(2)由题中 的实验现象,可推测猜想2是错误的。
(3)装置B的作用是 ;装置D的作用是 。
(4)根据反应前后固体的质量,可计算出Na 2SO 3的质量为 g,Na 2SO 4的质量为 g。
【总结提升】(1)若实验前称得Na 2O 2固体的质量为m 1g,充分反应后称得生成物固体质量为m 2g,则m 2的取值范围是 (用含m 1的关系式表示)
(2)请另外设计一种实验方案,定性验证过氧化钠与二氧化硫反应后所得固体产物的成分:

甜叶菊苷具有高甜度低热能的特点,是一种新型甜味剂,我国是全国最主要的生产国,实验小组欲探究甜叶菊苷的元素组成,进行如下实验:
[提出猜想]甜叶菊苷由什么元素组成?
[进行实验]小晴取适量的甜叶菊苷按如图1进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。
[讨论交流]其他同学认为小晴的实验设计不严谨,原因是 。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。
[继续探究]为了进步确定其元素组成。利用如图2进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)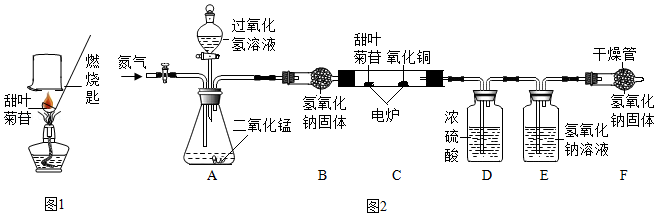
(1)实验前要通一会儿氮气,目的是 。
(2)A装置中发生反应的化学方程式为 。
[数据记录]4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重2.7g,E装置增重8.36g。(产物被完全吸收)
[分析与讨论]数据分析:4.02g 甜叶菊苷中氧元素的质量为 g,由此可以确定甜叶菊苷是由碳,氢,氧元素组成。
[反思评价]若没有F装置,对氧元素质量测定结果的影响是 。 (填“偏大”、“偏小”或“无影响”)。
兴趣小组利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液。探究酸碱盐的性质。小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]刺激性气味的气体是什么?
[猜想与假设]猜想1.可能是二氧化硫 猜想2.可能是氯化氢
猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是 。
[查阅资料]SO2和CO2的化学性质相似,都能使澄清石灰水变浑浊。写出二氧化硫和氢氧化钙的反应的化学方程式: 。
[实验探究]如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到 ,于是他认为猜想2正确。
[评价与改进]小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确。
|
实验操作 |
实验现象 |
|
如图所示,将产生的气体 |
|
[结论]加热氯化钠与硫酸的混合溶液得到的气体是氯化氢
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水。请推测实验室制取氯化氢气体最适宜的方法为 (填序号)。
A.加热氯化氢溶液和稀硫酸的混合物
B.加热氯化钠固体和稀硫酸的混合物
C.加热氯化钠固体和浓硫酸的混合物

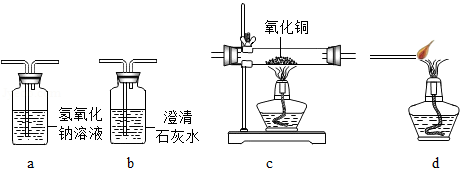
根据下列图示,回答相关问题

(1)实验一:实验中铜片上出现的现象是 ,该反应的化学方程式是 。
(2)实验二:自制简易净水器中小卵石,石英砂和蓬松棉的作用是 。
(3)实验三:仪器①的名称是 ;X、Y分别是水和汽油中的一种,加入X、Y后,观察到a中固体消失并得到棕色溶液,b中固体不消失,则物质X是 ,由实验可知,物质的溶解性与 有关。
小红同学将未知浓度的过氧化氢溶液34g,加入盛有0.5g二氧化锰的烧杯中,待完全反应后,称得烧杯中剩余物质的质量为33.7g。计算该过氧化氢溶液中溶质的质量分数。
某化学小组利用混有少量CO2的CO气体还原氧化铜,并验证反应后的气体产物。
(1)请写出用一氧化碳还原氧化铜的化学方程式 。
(2)实骏室现有如图所示实验装置(可重复使用)。按气体从左到右的方向,装置连接顺序正确的是 。
A.b→c→a→b→d
B.a→c→b→a→d
C.a→b→c→b→d
D.b→a→c→a→d