实验是进行科学探究的主要方法。如图A~H是初中化学常见的实验装置,请回答:
【查阅资料】常温下,CO2难溶于饱和NaHCO3溶液。
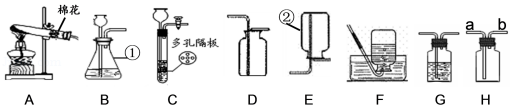
(1)写出仪器名称:① ② ;
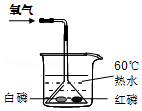
(2)写出用装置A制取氧气的化学方程式 ;用双氧水和二氧化锰制取氧气时,选择的发生装置和收集装置的组合是 (写出一种组合即可,填序号);实验室制取氧气时,选择的药品在组成上的共同点是 ;将制得的氧气通入图中,发现只有白磷燃烧,说明燃烧需要满足的条件是 。
(3)实验室用大理石和稀盐酸制取二氧化碳,既可以选用装置B又可选用装置C,相对于装置B,装置C的突出优点是 ;若用装置H收集二氧化碳时,气体应该从 (选填“a”或“b”)端通入;若用装置G除去生成气体中混有的氯化氢气体,则装置G中应盛放 。
某校化学兴趣小组在探究“酸碱盐的相关性质”时,做了如图一所示的两个实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到有气泡产生,为确认烧杯内溶液中溶质的成分,同学们进行了如下探究。

[查阅资料]Na2SO4溶液、NaCl溶液呈中性。
[提出猜想]猜想1:Na2SO4、NaCl;
猜想2:Na2SO4、NaCl和
猜想3:Na2SO4、NaCl和H2SO4
猜想4:Na2SO4、NaCl、H2SO4和Na2CO3
[交流讨论]小强同学认为猜想4一定是错误的,他的理由是 (用化学方程式表示)。
[进行实验]小明同学设计如下两个实验方案:
|
实验步骤 |
实验现象 |
实验结论 |
|
|
方案一 |
取少量烧杯中的溶液于洁净的试管中,加入几滴紫色石蕊溶液 |
|
猜想3正确 |
|
方案二 |
取少量烧杯中的溶液于洁净的试管中,加入少量铁粉 |
|
请写出方案二中有关反应的化学方程式 。
[反思与总结]分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑反应物是否过量。
化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,将其任意编号为:A、B、C、D、E,然后两两混合进行实验,其部分实验现象如下表(说明:硫酸钙视为可溶物)
|
实验 |
A+B |
B+C |
B+D |
C+D |
|
现象 |
产生沉淀 |
产生气体 |
产生沉淀 |
产生沉淀 |
(1)写出溶液A中溶质的化学式:A 。
(2)写出溶液A与B反应的化学方程式 。
(3)写出溶液C和D反应的化学方程式 。
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液68.0g,加入二氧化锰2.0g,待完全反应不再有气体逸出时,称得得剩余物质的总质量为68.4g。计算:
(1)反应完全后产生氧气的质量是 g。
(2)该过氧化氢溶液中溶质的质量分数(写出计算过程)
学习合金知识后,知道了不锈钢中含有金属铬。某同学想:铬与常见铁、铜相比,其金属活动性强弱如何呢?于是,和同学们一起进行了以下探究。
[查阅资料]①铬是银白色有光泽的金属,在空气中,像铝一样,其表面能产生致密的氧化膜:②能与稀硫酸反应,生成硫酸亚铬(CrSO4)。
[知识回顾]金属活动性顺序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au(在横线上填写对应金属的元素符号)
[作出猜想]猜想①Cr>Fe>Cu;猜想②Fe>Cu>Cr;猜想③ 。
[设计与实验]①张明同学取大小相等的铁、铜、铬三种金属片,未经打磨就分别放入等量等浓度的稀硫酸中,记录如下:
|
实验操作 |
铁片放在稀硫酸中 |
铜片放在稀硫酸中 |
铬片放在稀硫酸中 |
|
开始的现象 |
有少量气泡产生 |
无气泡 |
无气泡 |
|
结论 |
金属活动性强弱:Fe>Cu Fe>Cr |
||
②李红同学也取大小相等的铁、铜、铬三种金属片,先用砂纸打磨后再分别放入等量等浓度的稀硫酸中,记录如下:
|
实验操作 |
铁片放在稀硫酸中 |
铜片放在稀硫酸中 |
铬片放在稀硫酸中 |
|
开始的现象 |
产生少量气泡 |
无气泡 |
产生大量气泡 |
|
结论 |
金属活动性强弱: > > (填元素符号) |
||
[讨论交流]为什么张明和李红两个同学记录的铬与稀硫酸反应开始的现象截然不同?原因是 。
[实验验证]为了进一步确认铁、铜、铬三种金属的活动性强弱,刘斌同学将打磨过的两块铁片分别放入硫酸亚铬(CrSO4)溶液和硫酸铜溶液中,观察到在硫酸亚铬溶液中无明显现象,而在硫酸铜溶液中有明显的现象是 ,其反应的化学方程式是 。
[拓展迁移]写出铬与稀硫酸反应,生成CrSO4的化学反应方程式 。
如图是实验室制取气体并验证气体性质的装置:

(1)若将装置A和C相连接制取氧气,写出反应的化学方程式 ;检验氧气收集满的方法是 。
(2)若将装置B和D相连接用于制取二氧化碳气体并验证其化学性质,写出装置B中发生反应的化学方程式 ;可观察到试管中石蕊溶液 ;写出烧杯中二氧化碳与澄清石灰水反应的化学方程式 。