用某含有CO 2、水蒸气的还原性气体(可能含有CO、H 2中的一种或两种)经过如图的装置来确定其成分及C装置中Fe xO y的化学式。

(1)B装置的作用是 ,D装置的作用 。
(2)实验过程中观察到D中无明显变化,若澄清石灰水变浑浊,则还原性气体是 ,当C中的Fe xO y完全反应后,测得E和F的总质量增加3.52g,C中剩余固体质量为3.36g,则Fe xO y的化学式为 ,若没有A装置,则测得的x和y的比值将 (填"偏大"、"偏小"或"不变")。
上述实验中生成的二氧化碳用氢氧化钠溶液吸收,某工厂也利用此原理吸收生产中排放的二氧化碳,再通过一定的方法将二氧碳释放、储存达到回收再利用的目的,具体流程如图1(部分反应条件和试剂未标出)
根据图2回答下列问题
(3)分离池中发生的化学反应方程式为 。
(4)B为 (填化学式)
(5)"人类只一个地球!"防止温室效应的根本对策是全球参与控制二氧化碳的排放量","低碳生活从我做起"。请举出一例"低碳"生活的例子 (合理即可)。 
某工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁。现有废硫酸49t(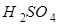 的质量分数为10%),与足量的废铁屑起反应,可生产硫酸亚铁的质量是多少?
的质量分数为10%),与足量的废铁屑起反应,可生产硫酸亚铁的质量是多少?
把10g铁和铜的混合物放到盛有足量盐酸的烧杯中,充分反应后,烧杯中物质的总质量比反应前(铁、铜混合物和盐酸)减少了0.2g,求原混合物中铜的质量分数.
某铁合金样品1.1g在氧气完全燃烧得到0.013g二氧化碳,通过计算确定该铁合金是生铁还是钢?
实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
请根据以上信息计算:样品中碳酸钙的质量分数?
同学们已经学习了氧气和二氧化碳的实验室制法,请你参与总结与分析:
【仪器认识】装置A中仪器的名称:a(1),b(2);装置C的名称:(3)
【反应原理】用双氧水和二氧化锰混合制取氧气的化学方程式为(4);
用大理石和稀盐酸制取二氧化碳的化学方程式为(5)。
【制取装置】用氯酸钾与二氧化锰制取氧气,可选用的发生装置是(6),若收集较纯净的氧气最好选用(7)装置,收满的现象是(8)。
实验室制取二氧化碳气体,可选用的装置组合是(9)或(10),
检验二氧化碳是否收满的方法是(11)(简述实验操作、现象、结论)。
比较B、C装置,C装置在制取气体时,明显的优点是(12)。
【数据分析】实验小组用氯酸钾和二氧化锰的混合物制取氧气,反应过程中混合物的质量变化如图所示。完全反应后最终收集到0.3 mol氧气。
①请根据化学方程式列式计算原混合物中含氯酸钾的质量。(13)
②图中P点处试管内的固体物质有(14)